
Clínica Las Americas - AUNA, Clínica Medellin, Universidad Pontifica Bolivariana.
Recibido 31 de Mayo 2024; aceptado 18 de julio 2024
Disponible en internet el 31 de julio 2024
Palabras Clave:Inmunonutrición, farmaconutrición, cáncer gastrointestinal, nutrición enteral, cirugía, arginina, ácidos grasos omega 3, nucleótidos, glutamina.
Key Words: Immunonutrition, pharmaconutrition, gastrointestinal cancer, enteral nutrition, surgery, arginine, omega-3 fatty acids, nucleotides, glutamine.
RESUMEN
En los últimos años, la nutrición enteral ha sido modificada con nutrientes específicos cuya finalidad principal es modular el sistema inmune. Diferentes metaanálisis resumen la evidencia de la inmunonutrición en pacientes con cirugía electiva abdominal mayor, tanto para el manejo del cáncer como para la patología benigna. La nutrición con arginina, ácidos grasos omega 3, nucleótidos y glutamina han sido utilizados en pacientes con cirugía abdominal; La mayoría de estos estudios sugieren que la administración enteral de inmunonutrientes reduce la tasa de complicaciones, tanto infecciosas como no infecciosas, así como disminución significativa en la estancia hospitalaria, con un mayor beneficio en los pacientes malnutridos. Existen datos insuficientes para establecer un periodo de tiempo de administración, una dosis específica y definir cuál de estos inmunonutrientes por sí solo tiene un mayor beneficio.
CONCLUSIÓN: : la administración perioperatoria de soporte nutricional enteral con inmunonutrientes, está relacionado con una disminución en la morbilidad y la estancia hospitalaria de los pacientes que son llevados a cirugía electiva mayor del tracto gastrointestinal, tanto en patología benigna como en pacientes con cáncer.
ABSTRACT
In recent years, enteral nutrition has been enhanced with specific nutrients designed to modulate the immune system. Various meta-analyses summarize the evidence of immunonutrition in patients undergoing major elective abdominal surgery, both for managing cancer and benign conditions. Nutrients such as arginine, omega-3 fatty acids, nucleotides, and glutamine have been used in these patients. Most studies suggest that enteral administration of these immunonutrients reduces the incidence of infectious and non-infectious complications. It also significantly shortens hospital stays, with greater benefits observed in malnourished patients. However, there is insufficient data to establish specific administration periods and dosages necessary to determine which immunonutrient offers the greatest benefit.
CONCLUSION: Perioperative administration of enteral nutritional support with immunonutrients is associated with decreased morbidity and hospital stay in patients undergoing major elective gastrointestinal surgery for benign conditions and cancer.
La patología abdominal electiva de tipo quirúrgico se convierte en una de las principales causas de ingreso a las unidades de cuidado intensivo; específicamente, con el aumento de la incidencia de cáncer a nivel mundial, son muchos los pacientes que son sometidos a resecciones abdominales de su patología cancerígena; muchos de estos pacientes ingresan con un alto grado de malnutrición, afectando tanto la sobrevida como el número de complicaciones perioperatorias; alterando a mediano plazo la calidad de vida con un deterioro importante de su estado funcional; muchos de estos pacientes presentan caquexia, definida como aquel estado de desnutrición asociado a debilidad y progresiva pérdida de peso hasta la emaciación; generalmente ocurre entre el 40-80% de los paciente en el transcurso de su enfermedad; es así como el soporte nutricional se convierte en una estrategia para mejorar el pronóstico.
Sumado al soporte nutricional estándar como terapia primaria, el uso de nutrientes que modulan la respuesta inmune se ha convertido en una práctica usual en el grupo de pacientes con cirugía abdominal mayor tanto de patología oncológica como no oncológica.
La inmunonutrición (IMN), comprende el uso de uno o más nutrientes que, suministrados de forma individual o de manera conjunta poseen efectos farmacológicos en el sistema inmune, impactando en el pronóstico clínico de los pacientes. Los nutrientes más estudiados que ejercen estas funciones son: arginina, ácidos grasos omega 3 (ω-3), nucleótidos y glutamina.
La inmunonutrición (IMN), comprende el uso de uno o más nutrientes que, suministrados de forma individual o de manera conjunta poseen efectos farmacológicos en el sistema inmune, impactando en el pronóstico clínico de los pacientes. Los nutrientes más estudiados que ejercen estas funciones son: arginina, ácidos grasos omega 3 (ω-3), nucleótidos y glutamina.
El uso de ciertos nutrientes toma importancia ayudando a optimizar la función inmune y la recuperación celular; este grupo de nutrientes hacen parte de fórmulas especializadas principalmente enterales las cuales contienen uno o varios de estos compuestos que en el mercado se conocen como inmunonutriente o farmaconutrientes; cuyo contenido varía de forma significativa tanto en la combinación de sus componentes como en la concentración de cada uno de estos (1,2,3).
Una limitación frecuente en los estudios es la utilización de estas fórmulas que contienen una mezcla de diferentes nutrientes, donde el beneficio de un imunonutrientes de forma individual es difícil de evaluar.
No es fácil definir una dosis adecuada de cada inmunonutriente, aún es más difícil soportar el uso de estos nutrientes de una forma individual más allá de una formula enteral especializada; no se puede atribuir los desenlaces clínicos a un solo nutriente, posiblemente la enfermedad de base y sus consecuencias sean más importantes a la hora de hablar de pronósticos mayores como mortalidad, estancia hospitalaria y complicaciones.
Uno de los mayores problemas es determinar la respuesta inmune para cada paciente, se conoce que existen respuestas homogéneas en ciertas enfermedades; es posible que la predisposición genética, el tipo de cáncer, las patologías de base y los hábitos podrían modificar la respuesta inmune y lo que por un lado beneficiaria algún tipo de paciente se puede convertir en un riesgo para otros.
En la literatura médica se han descrito resultados no favorables con el uso de la IMN; estos productos deberán ser manejados como fármacos, con dosis establecidas, ruta de administración, eventos adversos, duración establecida de tratamiento y probables complicaciones para usarlos de una manera adecuada (3-5).
Los principales inmunonutrientes utilizados en el paciente con cáncer son:
ARGININA
La arginina (Arg) es un aminoácido no esencial en un estado fisiológico normal y llega a ser condicionalmente esencial durante periodos de estrés hipermetabólico. Sirve como precursor para la síntesis de proteínas, urea, óxido nítrico y creatina; puede jugar un papel importante en el metabolismo intermedio de los pacientes críticamente enfermos y es el transportador de nitrógeno más abundante en nuestro organismo (6). La arginina participa en la síntesis de poliaminas (proliferación y crecimiento celular) y la síntesis de prolina (curación y síntesis de colágeno en las heridas). Además, es el sustrato de varias enzimas encargadas de su metabolismo: la óxido nítrico sintetasa, siendo la arginina el único sustrato biosintético para la producción de óxido nítrico (ON) a través de la ON sintetasa endotelial, ONS inducible, iONS y ONS neuronal. Este ON es una molécula intracelular que tiene influencia en todos los tipos celulares. Es importante en el mecanismo de la relajación del endotelio y como mediador de la respuesta inmune. La arginasa, cuyo metabolito es la ornitina, es importante en el mantenimiento del ciclo de la urea y la producción del colágeno. La arginina decarboxilasa, cuyo metabolito es la agmatina, tiene como función señalización tisular, neurotransmisor e inhibición de la proliferación celular. Y la arginina-glicina-aminotransferasa, cuyo metabolito es la creatina, tiene actividad ATP-asa, liberación de neurotransmisores y homeostasis del calcio.
Durante la sepsis predomina la vía de la NOS y la producción de ON; en trauma y cáncer predomina la vía de la arginasa, reduciendo los niveles de ON al disminuir los niveles de arginina disponibles, este déficit de L-Arg se ha asociado a una alteración de la expresión de genes relacionados con la activación de los macrófagos, limitando la proliferación de las células T, cambios que resultan en daños de la función inmune a diferentes niveles llevando a una respuesta inmune inadecuada (7,8); esta arginasa 1 es estimulada por citoquinas en las células mieloides; estas células mieloides supresoras (MSC) expresan grandes cantidades de arginasa especialmente en pacientes con cáncer depletando los niveles de arginina hacia la generación de ornitina, causando para algunos un síndrome de deficiencia de arginina (9). Simultáneamente, los linfocitos T dependen de los niveles de arginina para su proliferación, en estados de deficiencia de arginina se presenta una pérdida en la expresión de los complejos receptores y perdida de la memoria; estas anormalidades de las células T son observadas frecuentemente en pacientes con cáncer y trauma (10,11)
ACIDOS GRASOS OMEGA 3
Los ácidos grasos polinsaturados, PUFAS, entre ellos el ácido linoleico (n6) y el ácido alfa linolénico (n3) son constituyentes esenciales de la dieta. Estos PUFAS, junto con el ácido gamma linolénico (GLA), el ácido eicosapentaenoico (EPA) y el ácido araquidónico, son incorporados dentro de la membrana de los fosfolípidos y sirven como precursores eicosanoides, modulando la función tisular, el tono vascular y la inflamación. El ácido docosahexaenoico (DHA) puede ser formado desde el EPA y es precursor de docosanoides. El EPA y el DHA son obtenidos de alimentos marinos y su suplementación en la dieta ha mostrado efectos antiinflamatorios en humanos desde hace muchos años; es así como se ha demostrado un beneficio en el uso a largo plazo de omega 3 PUFA (ω-3PUFA) en enfermedades con componente inflamatorio significativo (12-15).
La respuesta inflamatoria puede ser afectada por los fosfolípidos presentes en las membranas de las células inmunes, la composición de los ácidos grasos de las membranas celulares pueden influenciar la fluidez de la membrana, la cual puede alterar la actividad de enzimas unidas a estas, receptores, trasportadores, y sistemas de segundos mensajeros basados en lípidos (16-18), particularmente algunos PUFAS pueden afectar la respuesta inflamatoria alterando los sustratos de producción de los mediadores inflamatorios incluyendo los eicosanoides.
Dietas especiales con ω-3PUFA (EPA y DHA) son esenciales para obtener efectos antiinflamatorios, reemplazando el ácido araquidónico en la membrana de los fosfolípidos y metabolizándose hacia series de eicosanoides menos proinflamatorios que los derivados del ácido araquidónico (19-21). Adicionalmente, el EPA y el DHA tienen funciones en la resolución de la inflamación como un proceso activo más que aboliendo señales inflamatorias (22). Nuevas moléculas llamadas resolvinas, protectinas, lipoxinas y maresinas (23-25) son mediadores lipídicos del EPA y DHA con potentes propiedades antiinflamatorias, reparadoras y neuroprotectoras (26,27) y juegan un papel importante en la reparación y resolución de la inflamación (25).
NUCLEÓTIDOS
La producción endógena de nucleótidos es un proceso metabólicamente costoso, principalmente en tejidos con alta tasa de división celular como los linfocitos y el tejido intestinal, los cuales requieren nucleótidos para la síntesis de ácidos nucleicos (28). Por lo tanto, es más eficiente utilizar nucleótidos ya formados provenientes de la dieta. Los nucleótidos son compuestos nitrogenados no proteicos que participan en diferentes procesos biológicos y son considerados nutrientes condicionalmente esenciales. Se ha encontrado que pueden tener diferentes efectos en la microbiota intestinal (29) y la función inmune (30,31). Los estudios han mostrado que los nucleótidos, ribonucleótidos y ácidos nucleicos tienen efecto sobre la respuesta de las células Th1 y Th2 (32-36); además incrementan la respuesta inmunológica de las células epiteliales intestinales con un aumento en la producción de inmunoglobulina A por la mucosa (37); la administración de ácido ribonucleico (RNA) modula la función de los linfocitos en el tejido adiposo, resultando en un efecto antiinflamatorio (38).
GLUTAMINA
La glutamina (GLN) es el aminoácido libre más abundante en el cuerpo y juega un papel regulatorio en diferentes procesos celulares específicos, incluyendo el metabolismo (fuente oxidativa, precursor gluconeogénico, precursor lipogénico), integridad celular (apoptosis, proliferación celular), síntesis proteica, potencial antioxidante, resistencia a la insulina, secreción de insulina, síntesis de proteínas contráctiles y de matriz extracelular, regulación en la expresión de genes relacionados con el metabolismo, señales de transducción, defensa y reparación celular y activación de vías de señales intracelulares. Por esto, su función va más allá de una simple fuente de energía metabólica o precursor proteico como se asumía previamente (39,40).
La glutamina (GLN), un aminoácido no esencial, ahora es catalogado en el grupo de condicionalmente esencial en pacientes en enfermedad crítica o sometidos a cualquier injuria o enfermedad (41-43). Se han encontrado algunos beneficios fisiológicos: atenúa la liberación de citoquinas, reduce el daño de órganos y mejora la sobrevida en modelos animales de endotoxemia (44); también ejerce un efecto antiinflamatorio mediado por la atenuación de varias vías de la inflamación, así como NF-kB (Nuclear factor kB), p38 MAPK (mitogen-activated protein kinases), ERK (extracellular signal-regulated kinase) y MKP-1 (MAPK phosphatase), y muestra una inhibición del incremento de la expresión de la enzima óxido nítrico sintetasa inducida (iNOS) (42); produce efectos protectores antiinflamatorios, aumentando la expresión de proteínas protectoras como la “heat shock protein 70” (HSP70) (45), la cual está asociada a protección celular induciendo mecanismos de tolerancia al estrés (46), y protege a las células de la injuria tisular por aumento de la expresión del “heat shock factor-1” (47); y ha sido relacionada en algunos estudios a una disminución tanto en la morbilidad de origen infeccioso como de la mortalidad (48,49).
En el paciente crítico, se han documentado niveles plasmáticos de glutamina por debajo de lo normal y se considera un predictor de mortalidad en estos pacientes (50).
El uso de glutamina en pacientes sometidos a quimioterapia con cáncer de esófago puede disminuir la aparición de mucositis (51,52).
Varios estudios fisiológicos de inmunonutrición y modulación en la respuesta inflamatoria, incluyendo arginina, RNA y ω-3PUFA, pueden aumentar el número de células linfocíticas CD4, CD8 y CD56 en el tumor, actuando como factor protector principalmente en cáncer colorectal (53); cambios en la respuesta inmune también han sido detectados en pacientes con otros tipos de tumores con el uso de inmunonutrientes (54).
La evidencia de INM en cirugía abdominal mayor está condensada en varios metaanálisis, los cuales se describen a continuación.
CIRUGIA ABDOMINAL MAYOR
La malignidad del tracto gastrointestinal ha sido una de las causas frecuentes de muerte a nivel mundial. La cirugía puede convertirse en un tratamiento curativo en algunos pacientes. Este tipo de cirugía está relacionado con el desarrollo de un número frecuente de complicaciones en el posoperatorio, posiblemente por diferentes factores como la desnutrición, la inmunosupresión o la injuria asociada al estrés quirúrgico. El soporte nutricional se convierte en uno de los pilares fundamentales para el manejo de estos. Diferentes trabajos muestran cómo la INM enteral, enriquecida al menos con 2 o más inmunonutrientes (arginina, nucleótidos, ω-3PUFA, glutamina), puede tener algún papel en modular la respuesta inmune y mejorar o disminuir la incidencia de las complicaciones en el postoperatorio (3, 49).
Diferentes estudios con resultados inmunológicos más que clínicos muestran beneficios teóricos de la implementación de ciertos nutrientes. En pacientes con cáncer gástrico hay evidencia de una disfunción en la capacidad fagocítica de los trombocitos; un estudio con suplementación de glutamina y ω-3PUFA mostró cómo la actividad fagocítica de las plaquetas sanguíneas mejora de una manera significativa en enfermedad loco regional o diseminación peritoneal (55); similares resultados han sido descritos solo con la suplementación de arginina en este tipo de pacientes (56).
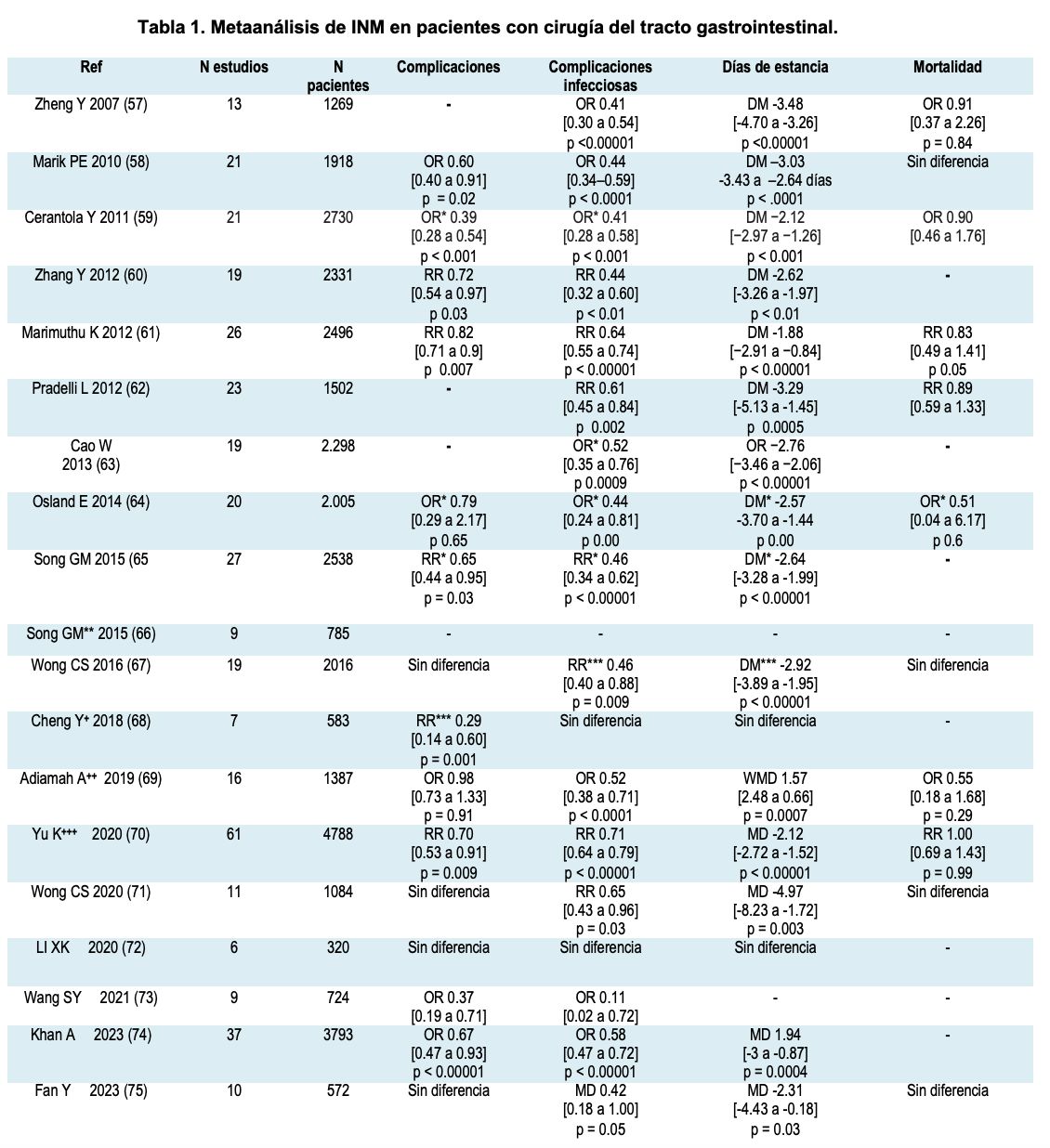
La mayor evidencia está acumulada en 19 metaanálisis (57-75) que condensan múltiples estudios aleatorios y controlados, que en la mayoría de casos muestran resultados consistentes (ver Tabla 1). En general, estos metaanálisis presentan en su mayoría resultados consistentes, cuyos estudios evalúan la INM perioperatoria (algunos con administración preoperatoria).

En general estos metaanálisis presentan en su mayoría resultados consistentes cuyos estudios evalúan la INM perioperatoria (algunos con administración preoperatoria, administración posoperatoria o ambos) comparado con la nutrición estándar; en ninguno se encontró diferencias significativas en la mortalidad; pero con un efecto estadísticamente significativo en la mayoría de los estudios en cuanto complicaciones no infecciosas (incluyendo la filtración de las anastomosis); complicaciones infecciosas (tanto la infección de la herida quirúrgica como otro tipo de infecciones relacionadas con el cuidado de la salud, infecciones pulmonares, urinarias y las relacionadas con los dispositivos) y una disminución en los días de estancia tanto en las unidades críticas como en los servicios de hospitalización; esto llevaría de una forma indirecta a una disminución del costo total hospitalario en los pacientes que han sido sometidos a una terapia de INM durante el perioperatorio de pacientes con cirugía abdominal mayor, comparado con el uso de nutriciones estándar. Una de las principales limitaciones en todos los estudios es la falta de determinación en el tiempo óptimo de inicio de la nutrición.
CONCLUSIONES
Los resultados de todos los metaanálisis, sugieren que el uso de INM comparado con la nutrición convencional, principalmente durante el perioperatorio, se convierte en un estándar para mejorar el resultado final en este tipo de pacientes. Es importante señalar que posiblemente el grupo de pacientes que más se beneficien de esta medida sean aquellos que se encuentren en riesgo de desnutrición o estén malnutridos.
BIBLIOGRAFÍA
1. Gil BA, Munera NE. Inmunonutrición durante el estado crítico. Quintero A, Nates J, Pujo I, Cárdenas. Eds. En Oncología Crítica. 2017:411-428. Distribuna Ed.
2. Pierre JF, Heneghan AF, Lawson CM, Wischmeyer PE, Kozar RA, Kudsk KA. Pharmaconutrition review: physiological mechanisms. JPEN J Parenter Enteral Nutr. 2013 Sep;37(5 Suppl):51S-65S.
3. Heyland D, Muscedere J, Wischmeyer PE, Cook D, Jones G, Albert M, Elke G, Berger MM, Day AG; Canadian Critical Care Trials Group. A randomized trial of glutamine and antioxidants in critically ill patients. N Engl J Med. 2013 Apr 18;368(16):1489-97.
4. Rice TW, Wheeler AP, Thompson BT, deBoisblanc BP, Steingrub J, Rock P; NIH NHLBI Acute Respiratory Distress Syndrome Network of Investigators. Enteral omega-3 fatty acid, gamma-linolenic acid, and antioxidant supplementation in acute lung injury. JAMA. 2011 Oct 12;306(14):1574-81.
5. Bertolini G, Iapichino G, Radrizzani D, Facchini R, Simini B, Bruzzone P, Zanforlin G, Tognoni G. Early enteral immunonutrition in patients with severe sepsis: results of an interim analysis of a randomized multicentre clinical trial. Intensive Care Med. 2003 May;29(5):834-40.
6. Zhou M, Martindale RG. Arginine in the critical care setting. J Nutr. 2007 Jun;137(6 Suppl 2):1687S-1692S.
7. Bansal V, Ochoa JB. Arginine availability, arginase, and the immune response. Curr Opin Clin Nutr Metab Care. 2003 Mar;6(2):223-8.
8. Rodriguez PC, Zea AH, DeSalvo J, Culotta KS, Zabaleta J, Quiceno DG, Ochoa JB, Ochoa AC. L-arginine consumption by macrophages modulates the expression of CD3 zeta chain in T lymphocytes. J Immunol. 2003 Aug 1;171(3):1232-9.
9. Popovic PJ, Zeh HJ 3rd, Ochoa JB. Arginine and immunity. J Nutr. 2007 Jun;137(6 Suppl 2):1681S-1686S.
10. Morris SM Jr. Recent advances in arginine metabolism. Curr Opin Clin Nutr Metab Care. 2004 Jan;7(1):45-51.
11. Albina JE, Mills CD, Henry WL Jr, Caldwell MD. Regulation of macrophage physiology by L-arginine: role of the oxidative L-arginine deiminase pathway. J Immunol. 1989 Dec 1;143(11):3641-6.
12. Lee TH, Hoover RL, Williams JD, Sperling RI, Ravalese J 3rd, Spur BW, Robinson DR, Corey EJ, Lewis RA, Austen KF. Effect of dietary enrichment with eicosapentaenoic and docosahexaenoic acids on in vitro neutrophil and monocyte leukotriene generation and neutrophil function. N Engl J Med. 1985 May 9;312(19):1217-24.
13. Zamaria N. Alteration of polyunsaturated fatty acid status and metabolism in health and disease. Reprod Nutr Dev. 2004 May-Jun;44(3):273-82.
14. Calder PC. Immunomodulation by omega-3 fatty acids. Prostaglandins Leukot Essent Fatty Acids. 2007 Nov-Dec;77(5-6):327-35.
15. Singer P, Shapiro H. Enteral omega-3 in acute respiratory distress syndrome. Curr Opin Clin Nutr Metab Care. 2009 Mar;12(2):123-8.
16. Stubbs CD, Smith AD. The modification of mammalian membrane polyunsaturated fatty acid composition in relation to membrane fluidity and function. Biochim Biophys Acta. 1984 Jan 27;779(1):89-137.
17. Murphy MG. Dietary fatty acids and membrane protein function. J Nutr Biochem. 1990 Feb;1(2):68-79.
18. Calder PC. The relationship between the fatty acid composition of immune cells and their function. Prostaglandins Leukot Essent Fatty Acids. 2008 Sep-Nov;79(3-5):101-8. Marangoni F, Angeli MT, Colli S, Eligini S, Tremoli E, Sirtori CR, Galli C. Changes of n-3 and n-6 fatty acids in plasma and circulating cells of normal subjects, after prolonged administration of 20:5 (EPA) and 22:6 (DHA) ethyl esters and prolonged washout. Biochim Biophys Acta. 1993 Dec 2;1210(1):55-62.
19. Marangoni F, Angeli MT, Colli S, Eligini S, Tremoli E, Sirtori CR, Galli C. Changes of n-3 and n-6 fatty acids in plasma and circulating cells of normal subjects, after prolonged administration of 20:5 (EPA) and 22:6 (DHA) ethyl esters and prolonged washout. Biochim Biophys Acta. 1993 Dec 2;1210(1):55-62.
20. Lee TH, Menica-Huerta JM, Shih C, Corey EJ, Lewis RA, Austen KF. Characterization and biologic properties of 5,12-dihydroxy derivatives of eicosapentaenoic acid, including leukotriene B5 and the double lipoxygenase product. J Biol Chem. 1984 Feb 25;259(4):2383-9.
21. Stapleton RD, Martin JM, Mayer K. Fish oil in critical illness: mechanisms and clinical applications. Crit Care Clin. 2010 Jul;26(3):501-14, ix.
22. Ariel A, Serhan CN. Resolvins and protectins in the termination program of acute inflammation. Trends Immunol. 2007 Apr;28(4):176-83.
23. Serhan CN, Yang R, Martinod K, Kasuga K, Pillai PS, Porter TF, Oh SF, Spite M. Maresins: novel macrophage mediators with potent antiinflammatory and proresolving actions. J Exp Med. 2009 Jan 16;206(1):15-23.
24. Serhan CN. Systems approach to inflammation resolution: identification of novel anti-inflammatory and pro-resolving mediators. J Thromb Haemost. 2009 Jul;7 Suppl 1:44-8.
25. Serhan CN, Chiang N, Van Dyke TE. Resolving inflammation: dual anti-inflammatory and pro-resolution lipid mediators. Nat Rev Immunol. 2008 May;8(5):349-61.
26. Serhan CN, Clish CB, Brannon J, Colgan SP, Chiang N, Gronert K. Novel functional sets of lipid-derived mediators with antiinflammatory actions generated from omega-3 fatty acids via cyclooxygenase 2-nonsteroidal antiinflammatory drugs and transcellular processing. J Exp Med. 2000 Oct 16;192(8):1197-204.
27. Serhan CN, Hong S, Gronert K, Colgan SP, Devchand PR, Mirick G, Moussignac RL. Resolvins: a family of bioactive products of omega-3 fatty acid transformation circuits initiated by aspirin treatment that counter proinflammation signals. J Exp Med. 2002 Oct 21;196(8):1025-37.
28. Carver JD. Dietary nucleotides: cellular immune, intestinal and hepatic system effects. J Nutr. 1994 Jan;124(1 Suppl):144S-148S.
29. Singhal A, Macfarlane G, Macfarlane S, Lanigan J, Kennedy K, Elias-Jones A, Stephenson T, Dudek P, Lucas A. Dietary nucleotides and fecal microbiota in formula-fed infants: a randomized controlled trial. Am J Clin Nutr. 2008 Jun;87(6):1785-92.
30. Hawkes JS, Gibson RA, Roberton D, Makrides M. Effect of dietary nucleotide supplementation on growth and immune function in term infants: a randomized controlled trial. Eur J Clin Nutr. 2006 Feb;60(2):254-64.
31. Gutiérrez-Castrellón P, Mora-Magaña I, Díaz-García L, Jiménez-Gutiérrez C, Ramirez-Mayans J, Solomon-Santibáñez GA. Immune response to nucleotide-supplemented infant formulae: systematic review and meta-analysis. Br J Nutr. 2007 Oct;98 Suppl 1:S64-7.
32. Nagafuchi S, Hachimura S, Totsuka M, Takahashi T, Goto M, Yajima T, Kuwata T, Habu S, Kaminogawa S. Dietary nucleotides can up-regulate antigen-specific Th1 immune responses and suppress antigen-specific IgE responses in mice. Int Arch Allergy Immunol. 2000 May;122(1):33-41.
33. Jyonouchi H, Sun S, Winship T, Kuchan MJ. Dietary ribonucleotides increase antigen-specific type 1 T-helper cells in the regional draining lymph nodes in young BALB/cJ mice. Nutrition. 2003 Jan;19(1):41-6.
34. Jyonouchi H, Sun S. An orally supplemented mononucleotide mixture prevents the decrease in T cell-dependent humoral immunity in C57BL/6 mice fed a nucleotide-free diet. J Nutr. 1996 Jun;126(6):1586-93.
35. Sudo N, Aiba Y, Takaki A, Tanaka K, Yu XN, Oyama N, Koga Y, Kubo C. Dietary nucleic acids promote a shift in Th1/Th2 balance toward Th1-dominant immunity. Clin Exp Allergy. 2000 Jul;30(7):979-87.
36. Nakamoto M, Shuto E, Hosaka T, Sakai T. Dietary deoxynucleic acid induces type 2 T-helper immune response through toll-like receptor 9 in mice. Eur J Nutr. 2011 Sep;50(6):421-6.
37. Nagafuchi S, Totsuka M, Hachimura S, Goto M, Takahashi T, Yajima T, Kuwata T, Kaminogawa S. Dietary nucleotides increase the mucosal IgA response and the secretion of transforming growth factor beta from intestinal epithelial cells in mice. Cytotechnology. 2002 Nov;40(1-3):49-58.
38. Sakai T, Taki T, Nakamoto A, Tazaki S, Arakawa M, Nakamoto M, Tsutsumi R, Shuto E. Dietary ribonucleic Acid suppresses inflammation of adipose tissue and improves glucose intolerance that is mediated by immune cells in C57BL/6 mice fed a high-fat diet. J Nutr Sci Vitaminol (Tokyo). 2015;61(1):73-8.
39. Curi R, Lagranha CJ, Doi SQ, Sellitti DF, Procopio J, Pithon-Curi TC, Corless M, Newsholme P. Molecular mechanisms of glutamine action. J Cell Physiol. 2005 Aug;204(2):392-401.
40. Wischmeyer PE. Glutamine: mode of action in critical illness. Crit Care Med.2007 Sep;35(9 Suppl):S541-4.
41. Lacey JM, Wilmore DW. Is glutamine a conditionally essential amino acid? Nutr Rev. 1990 Aug;48(8):297-309.
42. Singleton KD, Beckey VE, Wischmeyer PE. GLUTAMINE PREVENTS ACTIVATION OF NF-kappaB AND STRESS KINASE PATHWAYS, ATTENUATES INFLAMMATORY CYTOKINE RELEASE, AND PREVENTS ACUTE RESPIRATORY DISTRESS SYNDROME (ARDS) FOLLOWING SEPSIS. Shock. 2005 Dec;24(6):583-9.
43. Wischmeyer PE. Can glutamine turn off the motor that drives systemic inflammation? Crit Care Med. 2005 May;33(5):1175-8.
44. Wischmeyer PE, Kahana M, Wolfson R, Ren H, Musch MM, Chang EB. Glutamine reduces cytokine release, organ damage, and mortality in a rat model of endotoxemia. Shock. 2001 Nov;16(5):398-402.
45. Hamiel CR, Pinto S, Hau A, Wischmeyer PE. Glutamine enhances heat shock protein 70 expression via increased hexosamine biosynthetic pathway activity. Am J Physiol Cell Physiol. 2009 Dec;297(6):C1509-19.
46. Mestril R, Chi SH, Sayen MR, O'Reilly K, Dillmann WH. Expression of inducible stress protein 70 in rat heart myogenic cells confers protection against simulated ischemia-induced injury. J Clin Invest. 1994 Feb;93(2):759-67.
47. Morrison AL, Dinges M, Singleton KD, Odoms K, Wong HR, Wischmeyer PE. Glutamine's protection against cellular injury is dependent on heat shock factor-1. Am J Physiol Cell Physiol. 2006 Jun;290(6):C1625-32.
48. Griffiths RD, Jones C, Palmer TE. Six-month outcome of critically ill patients given glutamine-supplemented parenteral nutrition. Nutrition. 1997 Apr;13(4):295-302.
49. Ziegler TR, Young LS, Benfell K, Scheltinga M, Hortos K, Bye R, Morrow FD, Jacobs DO, Smith RJ, Antin JH, et al. Clinical and metabolic efficacy of glutamine-supplemented parenteral nutrition after bone marrow transplantation. A randomized, double-blind, controlled study. Ann Intern Med. 1992 May 15;116(10):821-8.
50. Oudemans-van Straaten HM, Bosman RJ, Treskes M, van der Spoel HJ, Zandstra DF. Plasma glutamine depletion and patient outcome in acute ICU admissions. Intensive Care Med. 2001 Jan;27(1):84-90.
51. Tanaka Y, Takahashi T, Yamaguchi K, Osada S, Shimokawa T, Yoshida K. Elemental diet plus glutamine for the prevention of mucositis in esophageal cancer patients receiving chemotherapy: a feasibility study. Support Care Cancer. 2015 Aug 13. [Epub ahead of print].
52. Tsujimoto T, Yamamoto Y, Wasa M, Takenaka Y, Nakahara S, Takagi T, Tsugane M, Hayashi N, Maeda K, Inohara H, Uejima E, Ito T. L-glutamine decreases the severity of mucositis induced by chemoradiotherapy in patients with locally advanced head and neck cancer: a double-blind, randomized, placebo-controlled trial. Oncol Rep. 2015 Jan;33(1):33-9.
53. Caglayan K, Oner I, Gunerhan Y, Ata P, Koksal N, Ozkara S. The impact of preoperative immunonutrition and other nutrition models on tumor infiltrative lymphocytes in colorectal cancer patients. Am J Surg. 2012 Oct;204(4):416-21.
54. Turnock A, Calder PC, West AL, Izzard M, Morton RP, Plank LD. Perioperative immunonutrition in well-nourished patients undergoing surgery for head and neck cancer: evaluation of inflammatory and immunologic outcomes. Nutrients. 2013 Apr 9;5(4):1186-99.
55. Kamocki ZK, Matowicka-Karna J, Szynaka B, Kedra B, Kemona H. Effects of perioperative immunostimulating nutritional therapy on the phagocytic activity of blood platelets in patients with various clinical stages of gastric cancer. Adv Med Sci. 2013;58(2):244-50.
56. Kamocki Z, Matowicka-Karna J, Gryko M, Zareba K, Kedra B, Kemona H. The effect of perioperative immunonutrition on the phagocytic activity of blood platelets in advanced gastric cancer patients. Clin Dev Immunol. 2013;2013:435672.
57. Zheng Y, Li F, Qi B, Luo B, Sun H, Liu S, Wu X. Application of perioperative immunonutrition for gastrointestinal surgery: a meta-analysis of randomized controlled trials. Asia Pac J Clin Nutr. 2007;16 Suppl 1:253-7.
58. Marik PE, Zaloga GP. Immunonutrition in high-risk surgical patients: a systematic review and analysis of the literature. JPEN J Parenter Enteral Nutr. 2010 Jul-Aug;34(4):378-86.
59. Cerantola Y, Hübner M, Grass F, Demartines N, Schäfer M. Immunonutrition in gastrointestinal surgery. Br J Surg. 2011 Jan;98(1):37-48.
60. Zhang Y, Gu Y, Guo T, Li Y, Cai H. Perioperative immunonutrition for gastrointestinal cancer: a systematic review of randomized controlled trials. Surg Oncol. 2012 Jun;21(2):e87-95.
61. Marimuthu K, Varadhan KK, Ljungqvist O, Lobo DN. A meta-analysis of the effect of combinations of immune modulating nutrients on outcome in patients undergoing major open gastrointestinal surgery. Ann Surg. 2012 Jun;255(6):1060-8.
62. Pradelli L, Mayer K, Muscaritoli M, Heller AR. n-3 fatty acid-enriched parenteral nutrition regimens in elective surgical and ICU patients: a meta-analysis. Crit Care. 2012 Oct 4;16(5):R184.
63. Cao W, Zhang CL. Enteral immunonutrition for malignant gastrointestinal tumor during perioperative period: A meta-analysis. Chin J Evid-based Med. 2013;13:992–1000.
64. Osland E, Hossain MB, Khan S, Memon MA. Effect of timing of pharmaconutrition (immunonutrition) administration on outcomes of elective surgery for gastrointestinal malignancies: a systematic review and meta-analysis. JPEN J Parenter Enteral Nutr. 2014 Jan;38(1):53-69.
65. Song GM, Tian X, Zhang L, Ou YX, Yi LJ, Shuai T, Zhou JG, Zeng Z, Yang HL. Immunonutrition Support for Patients Undergoing Surgery for Gastrointestinal Malignancy: Preoperative, Postoperative, or Perioperative? A Bayesian Network Meta-Analysis of Randomized Controlled Trials. Medicine (Baltimore). 2015 Jul;94(29):e1225.
66. Song GM, Tian X, Liang H, Yi LJ, Zhou JG, Zeng Z, Shuai T, Ou YX, Zhang L, Wang Y. Role of Enteral Immunonutrition in Patients Undergoing Surgery for Gastric Cancer: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Medicine (Baltimore). 2015 Aug;94(31):e1311.
67. Wong CS, Aly EH. The effects of enteral immunonutrition in upper gastrointestinal surgery: A systematic review and meta-analysis. Int J Surg. 2016 May;29:137-50.
68. Cheng Y, Zhang J, Zhang L, Wu J, Zhan Z. Enteral immunonutrition versus enteral nutrition for gastric cancer patients undergoing a total gastrectomy: a systematic review and meta-analysis. BMC Gastroenterol. 2018 Jan 16;18(1):11.
69. Adiamah A, Skořepa P, Weimann A, Lobo DN. The Impact of Preoperative Immune Modulating Nutrition on Outcomes in Patients Undergoing Surgery for Gastrointestinal Cancer: A Systematic Review and Meta-analysis. Ann Surg. 2019 Aug;270(2):247-256.
70. Yu K, Zheng X, Wang G, Liu M, Li Y, Yu P, Yang M, Guo N, Ma X, Bu Y, Peng Y, Han C, Yu K, Wang C. Immunonutrition vs Standard Nutrition for Cancer Patients: A Systematic Review and Meta-Analysis (Part 1). JPEN J Parenter Enteral Nutr. 2020 Jul;44(5):742-767.
71. Wong CS, Praseedom R, Liau SS. Perioperative immunonutrition in hepatectomy: A systematic review and meta-analysis. Ann Hepatobiliary Pancreat Surg. 2020 Nov 30;24(4):396-414.
72. Li XK, Zhou H, Xu Y, Cong ZZ, Wu WJ, Luo J, Jiang ZS, Shen Y. Enteral immunonutrition versus enteral nutrition for patients undergoing oesophagectomy: a systematic review and meta-analysis. Interact Cardiovasc Thorac Surg. 2020 Jun 1;30(6):854-862.
73. Wang SY, Hung YL, Hsu CC, Hu CH, Huang RY, Sung CM, Li YR, Kou HW, Chen MY, Chang SC, Lee CW, Tsai CY, Liu KH, Hsu JT, Yeh CN, Yeh TS, Hwang TL, Jan YY, Chen MF. Optimal Perioperative Nutrition Therapy for Patients Undergoing Pancreaticoduodenectomy: A Systematic Review with a Component Network Meta-Analysis. Nutrients. 2021 Nov 12;13(11):4049.
74. Khan A, Wong J, Riedel B, Laing E, Beaumont A, Kong J, Warrier S, Heriot A. The Impact of Peri-operative Enteral Immunonutrition on Post-operative Complications in Gastrointestinal Cancer Surgery: A Meta-Analysis. Ann Surg Oncol. 2023 Jun;30(6):3619-3631.
75. Fan Y, Li N, Zhang J, Fu Q, Qiu Y, Chen Y. The Effect of immunonutrition in patients undergoing pancreaticoduodenectomy: a systematic review and meta-analysis. BMC Cancer. 2023 Apr 17;23(1):351.
IDENTIFICACIÓN ORCID
Bladimir Alejandro Gil Valencia: 0000-0003-3521-6197
Norha Elena Munera Betancur: 0009-0005-0836-1825