
Universidad Autónoma de Chiriquí
Recibido 5 de marzo 2024; Aceptado 1 de abril 2024
Disponible en internet el 31 de julio 2024
Palabras Clave: arreflexia, debilidad, electromiografía, polineuropatía, parestesia
Key Words: areflexia, weakness, electromyography, polyneuropathy, paresthesia
RESUMEN
La polineuropatía desmielinizante inflamatoria crónica es la neuropatía crónica más frecuente dentro del grupo de las neuropatías desmielinizantes. Se caracteriza por presentar lesiones de naturaleza autoinmune, que afectan principalmente nervios periféricos y raíces nerviosas. Generalmente estos pacientes presentan debilidad proximal y distal crónicamente progresiva y disfunción sensorial de todas las extremidades. Se presenta el caso de un paciente masculino de 44 años con antecedente de diabetes mellitus tipo 2, el cual fue referido por su médico de cabecera y admitido en la sala de especialidades médicas del Hospital Regional Rafael Hernández en David, Chiriquí; por historia de aproximadamente 6 meses de inicio progresivo de parestesias con debilidad en miembros inferiores asociado a espasmos y dolor muscular, los cuales le dificultaban permanecer de pie y era incapaz de caminar al momento de su ingreso; además refería una pérdida de peso aproximada de 20 kg en dos meses. Al examen físico refería dolor al caminar, de intensidad 8/10 y pérdida de la sensibilidad en miembros inferiores, se observó debilidad (4/5) de la extensión de ambos miembros y arreflexia. Se solicitó un estudio de neuroconducción nerviosa el cual arrojó hallazgos electrofílicos compatibles con polineuropatía sensitiva motora de tipo axonal con compromiso de fibras sensoriales. Al paciente se le dio tratamiento con corticoide intravenoso, gabapentina e inmunoglobulina intravenosa.
ABSTRACT
Chronic inflammatory demyelinating polyneuropathy is the most frequent chronic neuropathy within the group of demyelinating neuropathies. It is characterized by presenting lesions of an autoimmune nature, mainly affecting peripheral nerves and nerve roots. These patients generally present with chronically progressive proximal and distal weakness and sensory dysfunction of all extremities. This case involves a 44-year-old male patient with a history of type 2 diabetes mellitus, who was referred by his family doctor and admitted to the medical specialties ward of the Rafael Hernández Regional Hospital in David, Chiriquí; due to a six month history of progressive paresthesia with weakness in the lower limbs associated with muscle spasms and pain, difficulty maintaining standing position and inability to walk.; Additionally, he reported a weight loss of approximately 20 kg in two months. In patient´s interview, he reported pain of 8/10 intensity when walking and loss of sensation in the lower limbs. Physical examination was notable for weakness (4/5) of the extension of both limbs and areflexia. A nerve conduction study was performed, which yielded electrophilic findings compatible with sensory-motor polyneuropathy of the axonal type with compromise of sensory fibers. The patient was treated with intravenous corticosteroids, gabapentin, and intravenous immunoglobulin.
INTRODUCCIÓN
La polineuropatía desmielinizante inflamatoria crónica (CIDP por sus siglas en inglés) es la neuropatía crónica tratable más frecuente en general dentro del grupo de las neuropatías desmielinizantes. Es un trastorno heterogéneo con una amplia progresión de fenotipos clínicos que se caracterizan por lesiones de naturaleza autoinmune, inflamatoria y desmielinizante, que afectan principalmente nervios periféricos y raíces nerviosas. La prevalencia estimada de CIDP en las distintas poblaciones del mundo es tan amplia como 0.8 a 8.9 por 100,000 habitantes. (1)
Generalmente, los pacientes con CIDP presentan debilidad proximal y distal crónicamente progresiva, escalonada o recurrente simétrica y disfunción sensorial de todas las extremidades, que se desarrolla durante al menos 2 meses, aunque puede ocurrir en un patrón de recaídas y remisiones con largos períodos de remisión (2). La patogenia de la CIDP está mediada por la inmunidad celular y humoral. El hallazgo patológico característico de la CIDP es la desmielinización segmentaria con presencia variable de infiltrados inflamatorios de predominio monocítico, pero también de linfocitos T CD4+ y CD8+ (3). El fenotipo clásico involucra compromiso simétrico de la fuerza muscular y la sensibilidad proximal y distal, asociado a arreflexia generalizada. (4)
Describimos a continuación un caso clínico con manifestaciones clínicas de inicio progresivo de parestesias y debilidad que indican una enfermedad desmielinizante progresiva con antecedentes de diabetes por historia. No se han identificado factores predisponentes específicos de CIDP, aunque alrededor del 50% de los pacientes padecen diabetes mellitus (5). Sin embargo, los pacientes con diabetes pueden desarrollar neuropatías inflamatorias donde la más común y más tratable es la polineuropatía desmielinizante inflamatoria crónica. El diagnóstico requiere la demostración de la desmielinización de nervios mediante estudios de electromiografía. Debido a la afectación de personas relativamente jóvenes, y a la gran discapacidad neurológica que puede generar, el tratamiento debiera ser iniciado tan pronto se diagnostique. Los pilares de la terapia son los corticoides intravenosos en altas dosis, inmunoglobulina intravenosa y la plasmaféresis, mientras que la terapia de mantenimiento es, principalmente, el uso de corticoides orales a bajas dosis.
El objetivo de este reporte es interpretar la presentación clínica de polineuropatía desmielinizante inflamatoria crónica de otras neuropatías asociadas a diabetes.
PRESENTACIÓN DEL CASO
Masculino de 44 años, referido por su médico familiar tratante y admitido en la sala de especialidades médicas el día 16 de septiembre del 2022, del Hospital Regional Rafael Hernández, por historia de evolución de aproximadamente 6 meses de inicio progresivo de parestesias con debilidad en miembros inferiores asociado a “calambres” y dolor muscular con intensidad 8/10 que le dificulta caminar distancias cortas y permanecer de pie por períodos prolongados. Refiere además pérdida de masa muscular y pérdida de peso significativa (aproximadamente 20 kg) de 2 meses de evolución. A su ingreso no camina por debilidad. Niega otros síntomas.
Antecedentes personales patológicos: Diabetes mellitus tipo 2, con diagnóstico desde hace 4 años y tratado con insulina (NPH) y metformina. Niega tabaquismo, alcoholismo y uso de sustancias ilícitas.
Antecedentes heredofamiliares: diabetes mellitus tipo 2 (ambos padres) y cáncer de mama (abuela).
Al examen físico los signos vitales son: frecuencia cardíaca: 96 lpm, frecuencia respiratoria: 20 rpm, presión arterial: 130/90, Sat. O2: 96%, Temperatura: 36°C. Paciente con edad aparente mayor a la cronológica, alerta, consciente, orientado en tiempo y espacio, cooperador que responde a las preguntas realizadas. Cabeza normo cefálica, sin lesiones evidentes; pupilas isocóricas normo reactivos a la luz; cuello, sin presencia de ingurgitación yugular, o adenopatías palpables; tórax, simétrico con buena entrada y salida de aire; en el apartado cardiaco ruidos cardiacos rítmicos, sin soplos, ni galopes; extremidades simétrica sin edemas, con pulsos periféricos palpables y llenado capilar menor de 2 segundos, en ambos miembros superiores se observa hiporreflexia, el paciente refiere dolor al caminar de intensidad 8/10 y pérdida de la sensibilidad en miembros inferiores, se observa debilidad (4/5) de la extensión de ambos miembros inferiores y arreflexia patelar y aquiliana en ambos miembros inferiores. Al examen epicrítico, el paciente presenta dificultad para seguir la dirección del movimiento pasivo resultando en una propiocepción afectada, carece de sensación al momento de colocarle el diapasón en miembros inferiores (vibración ausente). Además, presenta sensibilidad aumentada en ambas extremidades inferiores lo que le impedía mantenerse de pie por más de cinco minutos Con una escala de Glasgow de 15/15, sin alteración del habla y pares craneales conservados.
Con pruebas de laboratorio: Leucocitos en 4820/mm3, neutrófilos 2520/mm3, Hb 11.60 g/dl, Hct 32.90%, VMC 83.20 um3, HCM 29,30 pg, Plt 472 000, Glc 136 mg/dL, creatinina 0.78 mg/dL, nitrógeno de urea 10 mg/dL, ácido úrico 2.8 mg/dL, Sodio 130 mg/dL, potasio 3.88 mg/dL, calcio 9.50 mg/dL, cloro 94 mEq/L, albúmina 3.9 g/dl, globina 2.3 g/dL bilirrubina total 0.93 mg/dl, bilirrubina directa 0.20 mg/dl, bilirrubina indirecta 0.73 mg/dl, HDL 53 mg/dl, LDL 40 mg/dl, LDH 119 U/L, vitamina B12 688 pg/mL, ácido fólico 19.8 ng/mL, TP 13.3 segundos, TTP 30.4 segundos, INR 0.92 segundos, Glucosa en LCR 92 mg/dL, microproteína en LCR 86.52 mg/dL, en urinálisis Cet 1+, prot 1+, bacteriuria aislada. Electrocardiograma, ritmo sinusal. VIH negativo y VDRL no reactivo.
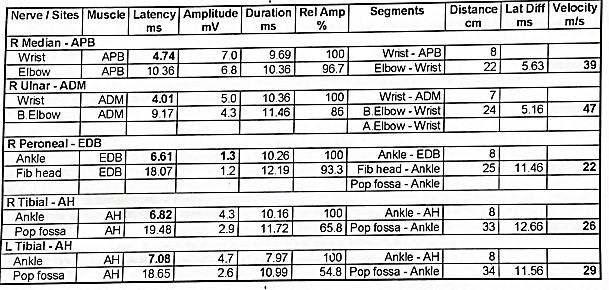
Al momento del ingreso se solicita estudio de velocidad de conducción nerviosa, que es realizado el mismo día (Imagen 1). El informe de medicina física y rehabilitación concluye que se trata de un estudio anormal que cuenta con hallazgos electrofisiológicos compatibles con polineuropatía sensitiva motora de tipo axonal con mayor compromiso de las fibras sensoriales.

El análisis de este examen de neuroconducción proporcionó la siguiente información: - La velocidad de conducción en el nervio mediano es de 39 m/s y en el nervio ulnar es de 47 m/s, lo cual está ligeramente por debajo del rango normal en las extremidades superiores ( >50 m/s). - La velocidad de conducción en el nervio peroneo es de 22 m/s, el nervio tibial derecho es de 26 m/s y el nervio tibial izquierdo es de 29 m/s; lo que demuestra una desmielinización significativa al encontrarse por debajo del rango normal en las extremidades inferiores ( >40 m/s). - Las latencias se encuentran prolongadas, en los miembros superiores se encuentra por encima de 4.5 ms y en los miembros inferiores de 6 ms.
- La amplitud es otro parámetro alterado en el caso de este paciente, ya que se encuentran relativamente bajas en los nervios periféricos, especialmente en el nervio peroneo en donde es 1.3 mV (lo normal es > 2 mV).
La reducción significativa de las velocidades de conducción es un indicativo de desmielinización, en este paciente se observa además, afectación de múltiples nervios motores y sensoriales con velocidades de conducción reducidas y latencias prolongadas, lo cual son características distintivas de la Polineuropatía Desmielinizante Inflamatoria Crónica.
DIAGNÓSTICO
Este paciente fue manejado como observación por Polineuropatía Desmielinizante Inflamatoria crónica (CIDP) porque cursaba con deterioro motor distal y déficits sensoriales, de evolución progresiva, asociados con factores clínicos como la hiporreflexia, que se corresponde con los criterios clínicos de la patología (6). Sin embargo, debido a su naturaleza autoinmune, se requieren pruebas complementarias que serían clínicamente relevantes para llegar al diagnóstico final del paciente. El diagnóstico de CIDP se basa en diferentes parámetros. La clínica facilita las indicaciones diagnósticas, la electrofisiología las respalda, y los resultados anatomopatólogos confirman la patología. La Federación Europea de Sociedades Neurológicas y Neurológicas Periféricas (EFNS/PNS) actualizó en 2010 los criterios diagnósticos para CIDP propuestos en 2005 para evitar la exclusión de presentaciones poco comunes. Siendo esta actualización, la más aceptada en la actualidad, los resumimos en la siguiente tabla:



TRATAMIENTO
Actualmente, el manejo farmacológico de primera línea, son las Inmunoglobulinas intravenosa, corticosteroides y plasmaféresis (6) Al segundo día intrahospitalario, se inicia tratamiento con metilprednisolona 750 mg por día por 3 días, la cual basa su evidencia en pequeños estudios, con calidad de evidencia muy baja. Varias series retrospectivas han demostrado que los corticosteroides son beneficiosos en CIDP, y que los resultados se pueden observar, después de 1 a 6 meses de tratamiento. Sin embargo, las recaídas son comunes una vez que se inicia la reducción gradual (6) Al cuarto día intrahospitalario, el paciente refiere mejoría en el dolor, se añade Gabapentina 30 mg cada noche vía oral, por los calambres. Al quinto día, intrahospitalario, inicia tratamiento con inmunoglobulina 20 g IV cada día la cual sería administrada por 5 días. La terapia con inmunoglobulina IV es eficaz para controlar la enfermedad a corto plazo, pero la mayoría de los casos requieren dosis de mantenimiento cada dos a seis semanas durante varios años. En cuanto a los efectos secundarios, los pacientes pueden experimentar dolor de cabeza, náuseas, fiebre, hemólisis, neutropenia, meningitis aséptica y lesión renal aguda. (6) La eficacia del tratamiento farmacológico se basa en la ausencia de progresión de los hallazgos clínicos, y la mejoría de los síntomas en las extremidades. Una prueba que se le realizó al paciente antes y luego de iniciar el tratamiento, fue solicitarle que se mantuviera de pie o intentara dar pasos. El paciente luego de administrar la inmunoglobulina no pudo mantenerse en pie durante mucho tiempo, sin embargo, refirió que a su llegada ni siquiera lograba mantenerse de pie, por lo que él lo consideraba una mejora de su condición La prueba cronometrada de ponerse de pie y caminar o una prueba de caminata de 10 metros es fácil de realizar y brinda información útil y objetiva para monitorear el progreso de CIDP. Estas evaluaciones deben realizarse antes y durante el tratamiento. (6)
DISCUSIÓN
Los pacientes con CIDP a menudo tienen comorbilidades que pueden influir en el diagnóstico y la elección del tratamiento, como diabetes mellitus. Aunque todavía se debate sobre si la diabetes es un factor de riesgo para CIDP, la prevalencia de diabetes es mayor en pacientes con CIDP, en comparación con la población general. (7) Según Rajabally (8), el término neuropatía diabética se refiere a las formas de neuropatía que son más prevalentes entre los pacientes diabéticos, que son la polineuropatía simétrica distal y neuropatías autonómicas diabéticas. Sin embargo, no todos los pacientes con diabetes tienen estas típicas neuropatías, sino que pueden desarrollar otras neuropatías inflamatorias tales como la polineuropatía desmielinizante inflamatoria crónica que es la más común y tratable. Como resultado, la CIPD no es el primer diagnóstico que reciben estos pacientes. Esto dependerá del tiempo y evolución para poder distinguir una neuropatía de otra. En el caso de la CIPD, el curso de la enfermedad es rápidamente progresiva. Lo contrario ocurre con la polineuropatía simétrica distal que tiene un progreso lento de los síntomas. La identificación de CIDP en pacientes diabéticos se basa en información clínica, electrofisiológica, de laboratorio y de imágenes nerviosas, combinada con criterios de diagnóstico de CIDP. (9) Debido a que la CIDP es rara, a menudo es difícil diagnosticar correctamente. Es una enfermedad que evoluciona en un período de más de 8 semanas, establecido por consenso, de manera de separar esta entidad de aquellas condiciones de curso agudo. (6) Si bien la sospecha inicial de CIDP es clínica, el diagnóstico se confirma por la evidencia de desmielinización de los nervios periféricos, que debe demostrarse mediante hallazgos electrodiagnósticos (10). Los criterios diagnósticos de CIDP, propuestos por la European Federation of Neurological Societies y la Peripheral Nerve Society (EFNS/PNS), son los más aceptados en la actualidad. Dichos criterios establecen que para realizar el diagnóstico de CIDP típico los pacientes deben cumplir, los dos siguientes aspectos: Clínica crónicamente progresiva, de debilidad proximal y distal simétrica y de disfunción sensorial en todas las extremidades, evolucionando por al menos 2 meses, con o sin afectación de pares craneales y reflejos osteotendíneos reducidos o ausentes en todas las extremidades. La debilidad de los músculos proximales se puede manifestar con dificultad para subir o bajar escaleras, levantarse de una posición sentada y levantar objetos por encima de la cabeza. Los signos y síntomas de la debilidad de los músculos distales pueden incluir raspaduras o golpes en los pies debido a la "caída del pie", dificultad con las tareas motoras finas, como abotonarse, y dificultad para abrir puertas o frascos. El paciente presentado cumple con ambos criterios, ya que él mismo refiere que sus síntomas iniciaron hace aproximadamente 6 meses demostrando la evolución crónica del cuadro, además se trata de un paciente que era incapaz de caminar o mantenerse de pie durante períodos prolongados y con ausencia de reflejos osteotendinosos en miembros inferiores y disminuidos en miembros superiores.
Según los criterios postulados por la EFNS/PNS una elevación de proteínas de líquido cerebroespinal con recuento de leucocitos menor de 10/mm3 apoyan el diagnóstico de la CIPD. A pesar de que en el paciente no fue posible estudiar el recuento de células en el LCR, impresiona la hiperproteinorraquia, presentando un valor de 66.52 mg/dL (valor normal 15 a 45 mg/dL). Aun cuando la mayoría de los pacientes con diabetes pueden tener niveles altos de proteína en LCR, los hallazgos electrodiagnósticos compatibles con los criterios postulados por la EFNS/PNS, demuestran que este aumento de proteínas en LCR puede estar relacionado con la CIDP.
De esta forma, junto la clínica y cumpliendo los criterios diagnósticos, se diagnostica CIDP. Es importante recalcar que tanto la clínica como las pruebas electrofisiológicas son fundamentales para realizar el diagnóstico de CIDP. (6) La presentación clínica del paciente inició con parestesias en miembros inferiores con evolución de seis meses sin compromiso motor lo que manifestaba una variante atípica de polineuropatía desmielinizante inflamatoria crónica. Esto se debe a que incluso CIDP clásico puede presentarse inicialmente con variantes puramente sensoriales o motores que evolucionan durante unos pocos meses a una variante sensoriomotora típica. (11) En cuanto al manejo del paciente, al igual que muchas enfermedades de origen autoinmune, no se conoce un mecanismo para evitar la afección. Actualmente, el tratamiento está orientado a mejorar la fuerza muscular y las escalas funcionales. (12) Los glucocorticoides, inmunoglobulina intravenosa o plasmaféresis, logran estabilizar parcial o totalmente, las manifestaciones clínicas. La inmunoglobulina humana (IgIV) se administra por vía intravenosa en ciclos mensuales o trimestrales a una dosis de 0,4 g/kg/día durante 5 días. El paciente presentado, inició su tratamiento de inmunoglobulina por 5 días, más corticoesteroides. Las IgIV, tienen la función de desactivar el sistema complemento, actúa sobre los linfocitos T CD4 y CD8, compite con el reconocimiento de antígenos, actúa sobre los linfocitos B, reduce la producción de anticuerpos, interfiere en la fagocitosis mediada por receptores, previene el efecto de los autoanticuerpos. Produce e inactivas citocinas y estimula la remielinización. Por su parte, los corticosteroides suprimen la respuesta inflamatoria, disminuyen la acción de los autoanticuerpos y las células T. (13). Junto con la fisioterapia adecuada, el paciente puede mejorar la fuerza, función y movilidad muscular y minimizar la deformación de músculos, tendones y articulaciones. Se desconoce el mecanismo terapéutico por el cual los corticosteroides causan efecto en pacientes con CIPD. Sin embargo, el tratamiento a largo plazo con estos medicamentos generan efectos adversos tales como Síndrome de Cushing iatrogénico, aumento de riesgo de Diabetes mellitus tipo 2 que aunado al paciente que ya presenta esta comorbilidad inhibe de forma significativa la secreción de la insulina y estimulan la liberación de glucagón. Entre otros efectos adversos se puede mencionar una dislipidemia aterogénica lo que favorece una esteatosis hepática. Además, el tratamiento prolongado de corticoides induce una pérdida rápida de masa ósea que se empieza a evidenciar tras los primeros seis meses. (15)
CONCLUSIÓN
La polineuropatía desmielinizante inflamatoria crónica es un trastorno heterogéneo con una amplia progresión de fenotipos clínicos que se caracteriza por una respuesta inmunitaria anómala que provoca desmielinización y destrucción axonal. La enfermedad puede presentarse con diferentes síntomas y existen al menos 15 conjuntos de criterios de diagnóstico que describen la CIDP y sus formas variantes. En todos los casos el diagnóstico se realiza con base en criterios clínicos y electrofisiológicos, cuyo objetivo es detectar todos aquellos pacientes que se beneficiarían de tratamiento inmunomodulador. Las neuropatías en pacientes que viven con diabetes, son comunes, pero los pacientes deben ser monitoreados de cerca para permitir un diagnóstico correcto y un adecuado tratamiento. La identificación de CIDP en pacientes diabéticos se basa en información clínica, electrofisiológica, de laboratorio y de imágenes nerviosas, combinada con criterios de diagnóstico de CIDP.
BIBLIOGRAFÍA
1. Dalakas M. Advances in the diagnosis, pathogenesis and treatment of CIDP. Nat Rev Neurol. 2011; 7(9): p. 507–517.
2. Kuwabara S, Misawa S. Chronic inflammatory demyelinating polyneuropathy. Advances in Experimental Medicine and Biology. 2019; 1190: p. 333-343.
3. Martín-Aguilar L, Pascual-Goñi E, Querol L. Autoanticuerpos en neuropatías inflamatorias inmunomediadas. Medicina Clínica. 2019; 153(9): p. 360-367.
4. Ferraz de Oliveira I, Correia L, Urzal J, Cruz S, Aldomiro F. Polirradiculoneuropatía desmielinizante inflamatoria crónica y diabetes: reporte de un caso. The Cureus Journal of Medical Science. 2022; 14(9).
5. Vargas Cañas ES, Chiquete E, Ruano-Calderón LA, León-Manríquez E, Salmerón-Mercado ME, Plascencia-Álvarez NI, et al. Recomendaciones sobre el diagnóstico y tratamiento de la polineuropatía desmielinizante inflamatoria crónica. Revista mexicana de neurociencias. 2017; 18(6): p. 1-19.
6. Vidal H, Meza C, Benítez J, Jorquera J, Meza R. Polineuropatía desmielinizante inflamatoria crónica: revisión a propósito de un caso. Revista Chilena de Neuropsiquiatría. 2019; 57(3): p. 283-294.
7. Chaudhary U, Rajabally Y. Infradiagnóstico y retraso diagnóstico en la polineuropatía desmielinizante inflamatoria crónica. Journal of Neurologý. 2021; 268(4): p. 1366-1373.
8. Rajabally YA, Stettner M, Kieseier BC, Hartung HP, Malik R. CIDP and other inflammatory neuropathies in diabetes - diagnosis and management. Nature Reviews. Neurology. 2017; 13(10): p. 599-611.
9. Chen Y, Tang. Chronic inflammatory demyelinating polyradiculoneuropathy in association with concomitant diseases: Identification and management. Frontiers in Immunology. 2022; 13.
10. Lewis R, Ashok Muley S. [UPTODATE].; 2022 [cited 2022 Diciembre 27. Available from: https://www.uptodate.com/contents/chronic-inflammatory-demyelinating-polyneuropathy-etiology-clinical-features-and-diagnosis?search=chronic-inflamatorio-desmielinizante-polineuropat%C3%ADa-etiolog%C3%ADa-clinical-features-and-diagnosis&source=search_resul.
11. Doneddu P, Cocito D, Manganelli F, Fazio R, Briani C, Filosto M, et al. PDIC atípica: criterios diagnósticos, progresión y respuesta al tratamiento. Datos de la base de datos italiana CIDP. Journal of neurology, neurosurgery, and psychiatry. 2019; 90(2): p. 125-132.
12. Nogués M, Varela F, Seminario G, Insúa MC, Bezrodnik L. Inmunoglobulina subcutánea: Tratamiento en polineuropatía desmielinizante inflamatoria crónica. Medicina (Buenos Aires). 2016; 76(1): p. 36-39.
13. Hernández. Polineuropatía desmielinizante inflamatoria crónica: Aspectos clínicos y electrofisiológicos. Acta Neurológica de Colombia. 2012; 28(4): p. 202-212.
14. Van Doorn P, Hadden R, Avau B, Vankrunkelsven P, Allen J, Attarian S, et al. Directrices de la Academia Europea de Neurología/Sociedad de Nervios Periféricos sobre el diagnóstico y tratamiento de la polirradiculoneuropatía desmielinizante inflamatoria crónica: Informe de un grupo de trabajo conjunto: segunda revisión. European Journal of Neurology. 2021; 28(11): p. 3556-3583.
15. Gutiérrez-Restrepo, J. (2021). Efectos adversos de la terapia con glucocorticoides. IATREIA, 34(2), 137–150. https://doi.org/10.17533/udea.iatreia.96
IDENTIFICACIÓN ORCID
Alexandra Contreras: 0009-0009-1170-9473
Yelenis González: 0009-0009-1170-9473
Shandell Herrera: 0009-0006-8802-1843
Sandy Sanches: 0009-0002-6305-886X