
Residente de Servicio de Cardiología, Instituto Cardiovascular y Torácico de Panamá, Ciudad de Panamá, Panamá 1
Especialista en Cardiología y Electrofisiología Cardiaca. Instituto Cardiovascular y Torácico de Panamá, Ciudad de Panamá, Panamá 2
Recibido 20 de Marzo 2024; aceptado 28 de julio 2024
Disponible en internet el 31 de julio 2024
Palabras Clave: Síndrome de Brugada, Canalopatías, Muerte Súbita, SCN5A, Bloqueo rama derecha, Score de Shanghái
Key Words: Brugada Syndrome, channelopathies, Sudden Death, SCN5A, Right Bundle Branch Block, Shanghai Score
Resumen
La pérdida transitoria del estado de alerta, el presincope o lipotimias son causas frecuentes de ingresos al servicio de urgencia e implican un reto diagnóstico establecer la clasificación fisiopatológica y la evaluación del riesgo. Cuando sospechamos de un presincope de etiología eléctrica la evaluación electrocardiográfica de patrones de riesgos es fundamental en el abordaje diagnóstico.
A continuación, se presenta el caso de un hombre de 65 años refiere historia de fiebre tras una infección de vías respiratorias superior, historia de presincope y cambios en segmento ST en derivadas precordiales en el que se sospechó inicialmente un síndrome coronario agudo. El electrocardiograma de derivadas altas permitió identificar un patrón de Brugada tipo 1 desenmascarado por el cuadro febril del paciente no relacionado a una cardiopatía estructural. El abordaje por electrofisiología y genética permitió confirmar el diagnóstico de Síndrome de Brugada por mutación del canal de sodio con características electrofisiológicas de alto riesgo.
Abstract
Transient loss of consciousness, presyncope or lipothymia area common causes of admissions to the emergency department and imply a diagnostic challenge to establish the pathophysiological classification and risk assessment. When we suspect presyncope of electrical etiology, electrocardiographic evaluation of risk patterns is essential in the diagnostic approach
We present a case of a 65-year-old man who was admitted in the emergency room with fever and ST elevation in precordial leads and acute coronary syndrome was initially suspect. The standard and High Lead electrocardiogram position allowed to identify a Brugada Type I pattern unmasked by the patients’ febrile syndrome. The electrophysiology and genetic approach confirm the diagnosis of Brugada Syndrome due to a sodium channel mutation with high risk of sudden death.
Introducción
El síndrome de Brugada fue descrito por primera vez en 1992 por Pedro y Josep Brugada como un bloqueo de rama derecha con elevación de segmento ST en derivadas precordiales derecha en pacientes con historia de parada cardiaca. Hoy en día se conoce como una canalopatías hereditaria infrecuente caracterizado por un corazón estructuralmente normal.
Se describe principalmente entre las personas de sexo masculino en su cuarta a quinta década de la vida y presenta una prevalencia estimada es de 5 por cada 10 000 personas.
El diagnóstico se basa en reconocer los patrones electrocardiográficos típicos esporádicos o reproducibles mediante pruebas farmacológicas. Un porcentaje importante de pacientes pueden encontrarse asintomáticos al momento del diagnóstico y los trastornos de repolarización electrocardiográficos (elevación de segmento ST) suelen ser reconocidos erróneamente como un síndrome coronario agudo. Debido al potencial riesgo de muerte súbita es importante una evaluación experta para predecir el riesgo del paciente y la necesidad del implante del desfibrilador cardiaco.
Presentación del Caso
Hombre de 65 años sin antecedentes patológicos ingresa a servicio de urgencia por cuadro febril asociado a presincope y debilidad generalizada. Durante su evaluación se evidenció elevación de segmento ST en precordiales y es referido al servicio de cardiología por sospecha de síndrome coronario agudo. El paciente negaba de dolor torácico, síncope, palpitaciones o equivalentes anginosos. Cursa con síndrome gripal en las últimas 24horas asociado a síntomas generales de cefalea, escalofríos y fiebre cuantificada. Es de ascendencia asiática y presenta historia familiar de muerte por arritmias cardiacas en la madre y abuela materna, y antecedente de muerte súbita reanimada en el hermano por lo que le han implantado un desfibrilador reciente.
El examen físico cardiovascular no se auscultó soplo cardiaco o ritmo de galope, sin datos de congestión central o periférica. El examen pulmonar no se auscultaron crépitos o roncus y el resto del examen físico no reveló cardiovascular patología aguda.
Exámenes Complementario
A su ingreso no se evidenció aumento de los niveles de troponinas cardiacas de alta sensibilidad o péptidos natriuréticos (NT-Pro-BNP 18 pg/ml), el conteo celular mostraba leve leucocitosis con neutrofilia del 93%. La química sanguínea era normal, la función renal era adecuada con tasa de filtración glomerular de 106 mL/min/m2, sin desequilibrio hidroelectrolítico o acido base. Se realizó un panel respiratorio viral nasofaríngeo descartando infección por COVID -19 o influenza, los cultivos sanguíneos fueron negativos.
La radiografía de tórax no demostró infiltrado o consolidado en parénquima pulmonar sugestivo a neumonía, el índice cardio torácico se encontraba en dimensiones normales.
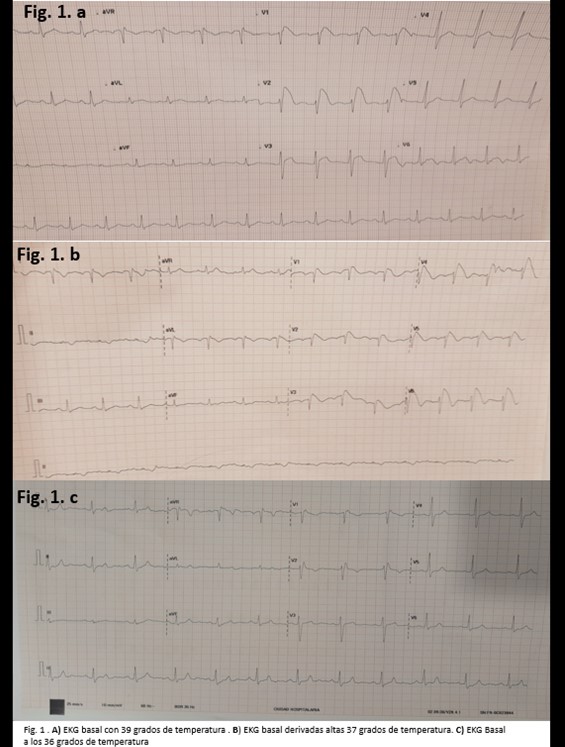
El electrocardiograma a su ingreso tomado a los 39 grados de temperatura corporal mostraba ritmo sinusal con elevación cóncava de segmento ST en derivadas V1-V2, el ángulo de Conrrado calculado fue de 50 grados compatible con un patrón de Brugada tipo 1. La duración del QRS fue del 80 ms y no se observó fragmentación del mismo. El intervalo PR se encontraba levemente prolongado en 230 ms. Se decide realizar un electrocardiograma de derivadas altas evidenciando el patrón de Brugada en precordiales (V1-V6) y presencia de onda R de 1.0 mV en aVR con una relación R/q de 1, además de elevación de ST en AVR mayor de 0.5 mV (ver figura 1 a y b). un retraso en la despolarización en derivadas laterales es evidenciado (presencia de ondas S profundas DI y aVL). Luego de normalización de temperatura corporal se observa ritmo sinusal con bloqueo incompleto de rama derecha y se evidencia desaparición de patrón de Brugada en precordiales. (ver figura 1 c)

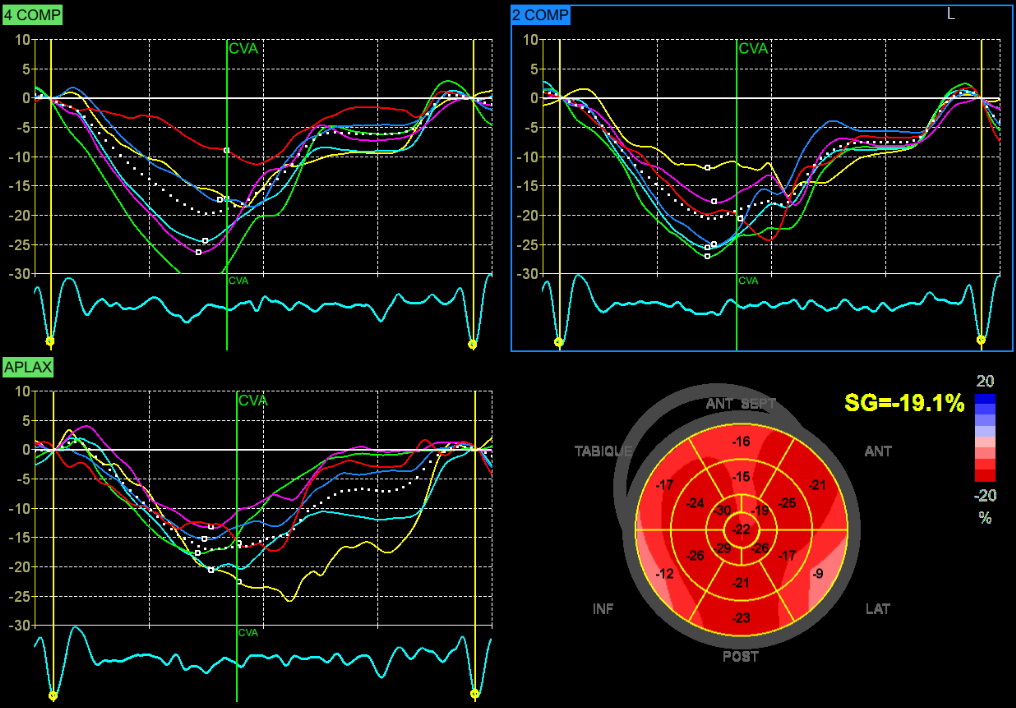
El ecocardiograma transtorácico muestra dimensiones normales del ventrículo izquierdo e hipertrofia concéntrica. En reposo no se evidencian alteraciones de la contractilidad global o segmentaria. La función sistólica es normal (FEVI biplano 62% SGL -19%).(figura 2)
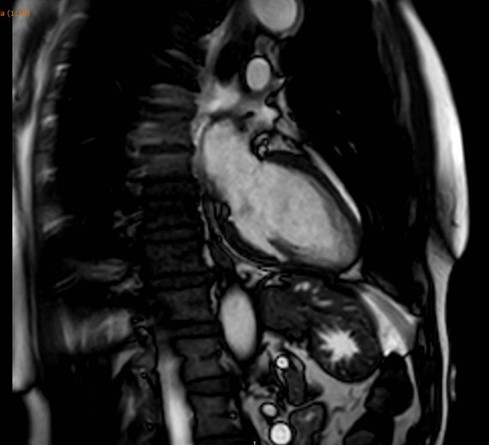
La resonancia magnética cardiaca no presenta evidencia de edema miocárdico en la secuencia T2 ni defectos de perfusión. Las secuencias de realce tardío no evidencian fibrosis intramiocardico, patrón inflamatorio o cicatriz por infarto. (figura 3)
Diagnóstico
La secuenciación genómica identificó una variante patogénica para el gen SCN5A que codifica el canal de sodio NaV1.5 con patrón de herencia autosómica dominante El score de Shanghái calculado fue de 4 puntos (patrón de Brugada tipo 1 inducido por fiebre 2+, historia de muerte súbita en hermano no explicada 0.5+, test genético con mutación asociado a síndrome de Brugada 0-5+) estableciendo un diagnóstico definitivo de síndrome de Brugada con un riesgo arrítmico del 3.4% a 5 años y un riesgo del 5% a los diez años.
Tratamiento
Se inició control de temperatura con antipiréticos intravenosos evidenciándose normalización del patrón de Brugada en los electrocardiogramas en reposo.
En los pacientes asintomáticos con un patrón de Brugada tipo 1, la estratificación del riesgo arrítmico es un reto. El mapeo electrofisiológico y la inducción de arritmia mediante fue discutida durante la hospitalización del paciente y se considero el riesgo de arritmia por la identificación de variables electrocardiográficas de alto riesgo: la presencia de onda R en derivadas aVR y el patrón tipo 1 durante la fiebre y la historia familiar de muerte súbita permitió decidir la implantación de desfibrilador cardioimplantable bicameral para prevención primaria e inicio de terapia antiarrítmica con Quinidina. A su egreso fue referido para tamizaje y asesoría genética.
La interrogación del desfibrilador a los 2 meses del egreso hospitalario, no evidencio arritmias ventriculares o carga arrítmica significativas.
Discusión
El síndrome de Brugada forma parte del grupo de canalopatías hereditarias que predispone al paciente a riesgo de arritmias ventriculares fatales y muerte súbita. (1) La guía de arritmias ventriculares de la sociedad europea de cardiología define como criterios diagnósticos el patrón electrocardiográfico de elevación cóncava del segmento ST mayor de 2 mm e inversión de onda T en las precordiales derechas (V1 o V2) producido de forma espontánea o provocada tras la administración de fármacos bloqueadores de sodio y fiebre. (2)
El síndrome de Brugada (Sbr) familiar es causado principalmente por pérdida de función en el gen SCN5A, que codifica la subunidad alfa del canal de sodio NaV1.5, provocando propiedades de activación defectuosas y un tráfico reducido por la membrana celular, lo que resulta en una duración del potencial de acción más corta y una reducción en la corriente máxima de sodio. (3)
Se han identificado nueve canales de sodio (1.1-1.9) en humanos, siendo Na V 1,5 la isoforma cardíaca, se pueden expresar otras isoformas cardíacas como Na V 1,4 y Na V 1,8, aunque con densidades más bajas. Na V 1.5 consta de una subunidad a y subunidades b auxiliares, y su activación conduce a la entrada de iones de sodio durante la despolarización cardíaca. (4)
Incompletamente entendida y probablemente heterogénea en naturaleza; existe la relación débil entre las variantes del gen SCN5A (3p21), la función del canal de sodio y el fenotipo clínico, además de factores poligénicos para la expresión fenotípica del síndrome. (5)
Se han observado anomalías tanto de la despolarización como de la repolarización, resultado de un trastorno de la despolarización primaria apoyado por cambios estructurales epicárdicos del ventrículo derecho como lo son el aumento del colágeno y fibrosis del TSVD, junto con reducción de la conexina-43. (6)
Los cambios del ECG pueden volverse evidentes en presencia de desencadenantes como fiebre, intoxicación (alcohol, cocaína o cannabis), estimulación vagal, desequilibrio electrolítico, anestésicos, agentes psicotrópicos y bloqueadores de sodio. (7)
La fiebre es un factor precipitante de alrededor del 18% de los pacientes con Sbr tipo 1 y se ha evidenciado analizando su estabilidad termodinámica encontrando inestabilidad a ΔG ≥ 1 kcal/mol siendo lo normal ΔG = −5 kcal/mol. (8)
A pesar del conocimiento de la fisiopatología en el síndrome de Brugada, la estratificación del riesgo es compleja. El patrón electrocardiográfico espontaneo de Brugada tipo 1 guarda una fuerte correlación entre mutación del gen SCN5A y la recurrencia de fibrilación ventricular. La presencia de fibrilación auricular puede encontrarse hasta en un 15% de los pacientes con síndrome de Brugada y se considera un factor de riesgo independiente para arritmias ventriculares letales y muerte súbita (HR 3.70; P = 0.0024) (9)
Otros patrones electrocardiográficos como la prolongación de intervalo PR, fragmentación del QRS y una duración de QRS mayor de 120 ms se asocian a un incremento de riesgo de muerte súbita en estos pacientes. (9)
El tratamiento consiste en evitar la exposición a drogas, el manejo antipirético en pacientes febriles. El antiarrítmico de elección es la Quinidina que inhibe la corriente de potasio.
En los pacientes con Brugada e historia de arresto cardiaco, el implante de desfibrilador (DAI) por prevención secundaria está indicado. La decisión del implante del DAI en prevención primaria se basa en presencia las características clínicas de alto riesgo como la presencia de sincope y criterios electrocardiográficos de riesgos. (10)
El mapeo electrofisiológico es recomendado en pacientes asintomáticos con patrón espontaneo de Brugada tipo 1 (Recomendación IIb, C) y permite detectar las regiones de fibrosis epicardica del tracto de salida del ventrículo derecho que son responsable de la elevación del segmento ST. Los estudios electrofisiológicos consisten en un realizar 2 estímulos ventriculares (en ápex del ventrículo derecho y tracto salida de ventrículo derecho) con diferentes longitudes de ciclo (600 a 400 ms), se considerará positivo la presencia de una taquicardia ventricular sostenida con una duración mayor de 30 segundos o si se requiere intervención de emergencia. (11) La ablación del sustrato epicardico del TSVD puede suprimir la recurrencia de fibrilación ventricular y normalización electrocardiográfica. (2)
Por su patrón de herencia autosómico dominante la mayoría de los pacientes presentará un familiar afectado por lo que se debe realizar consejera genética al probando y sus familiares (figura 4). (12) En general la principal mutación genética asociada al síndrome de Brugada consiste en una pérdida de función del gen SCN5A en los que podemos observar en un 20% el patrón electrocardiográfico típico de forma espontánea.(12)

En el tamizaje de un paciente con fenotipo de síndrome de Brugada debemos analizar otros genes como el SCN10A, SCN4A, SCN1B, KCNH2, TPM1, PKP2 se han descrito en el síndrome de Brugada. Debido a que las mutaciones en el gen SCN5A se han descrito en diversas patologías cardiacas, podremos encontrar un solapamiento entre el síndrome de Brugada y otras miocardiopatías como la displasia arritmogenica del ventrículo derecho por lo que se recomienda en pacientes con alta sospecha la evaluación de mutaciones genéticas asociadas a la displasia (PLP2). (13)
Referencias Bibliográficas
1. Nakano Y, Shimizu W, et al. Brugada Syndrome as a Major Cause of Sudden Cardiac Death in Asians. JACC: Asia. 2022 Jul 19; 2 (4) :412–421. PMID: 36339362
2. Zeppenfeld, K., Tfelt-Hansen, J., Riva, M. d., Winkel, B. G., Blom, N. A., & all, e. (26 de agosto de 2022). 2022 ESC Guidelines for the managment of patients with ventricular arrhytmias and the prevention of sudden cardiac death. European Heart Journal, 43, 4079-4081. doi: https://doi.org/10.1093/eurheartj/ehac262
3. Begoña Benito, Josep Brugada RB y PB. Síndrome de Brugada. Rev Esp Cardiol. 2009 nov ;62(11):1297–315. PMID: 19889341.
4. Amin AS, Asghari-Roodsari A, Tan HL. Cardiac sodium channelopathies. Pflugers Arch Eur J Physiol. 2010 jul;460(2):223–37. PMID: 20091048
5. Andrew D. Krahn, MD, Elijah R. Behr, MBBS MD, b Robert Hamilton, MD, MHSC, c Vincent Probst, MD, PHD D, Zachary Laksman, MD, MSC, a Hui-Chen Han, MBBS Phd. Brugada syndrome. JACC Clin Electrophysiol. 2022 Mar;8(3): 386-405. PMID: 35331438
6. Pieroni M, Notarstefano P, Oliva A, Campuzano O, Santangeli P, Coll M, et al. Electroanatomic and Pathologic Right Ventricular Outflow Tract Abnormalities in Patients With Brugada Syndrome. J Am Coll Cardiol. 2018 Dec 4 ;72(22):2747–2757. PMID: 30497561
7. Wilde AAM, Amin AS. Clinical Spectrum of SCN5A Mutations: Long QT Syndrome, Brugada Syndrome, and Cardiomyopathy. JACC Clin Electrophysiol. 2018 May;4(5):569–79, PMID: 29798782.
8. Chen GX, Barajas-Martínez H, Ciconte G, Wu CI, Monasky MM, Xia H, et al. Clinical characteristics and electrophysiologic properties of SCN5A variants in fever-induced Brugada syndrome. EBioMedicine. 2023 Jan; 87:1–15. PMID: 36516610
9. Vitali F, Brieda A, Balla C, Pavasini R, Tonet E, Serenelli M, Ferrari R, Delise P, Rapezzi C, Bertini M. Standard ECG in Brugada Syndrome as a Marker of Prognosis: From Risk Stratification to Pathophysiological Insights. J Am Heart Assoc. 2021 May 18;10(10). PMID: 33977759; PMCID: PMC8200706.
10. El-Battrawy I, Roterberg G, Liebe V, Ansari U, Lang S, Zhou X, Borggrefe M, Akin I. Implantable cardioverter-defibrillator in Brugada syndrome: Long-term follow-up. Clin Cardiol. 2019 oct;42(10):958-965. doi: 10.1002/clc.23247. Epub 2019 Aug 22. PMID: 31441080;
11. Gaita, F., Cerrato, N., Giustetto, C., Martino, A., Bergamasco, L., & all, P. C. (14 de November de 2023). Asymtomatic patients with Brugada ECG Pattern : Lon -Term Prognosis From a Large Prospective Study. Circulation, 1543-1555. doi:DOI: 10.1161/CIRCULATIONAHA.123.064689
12. Brugada, R., Campuzan, O., Sarquella-Brugada, G., Brugada, P., Brugada, J., & Hong, K. (25 de August de 2022). Brugada Syndrome. U.S National Library of Medicine, 2-8. Obtenido de https://www.ncbi.nlm.nih.gov/books/NBK1517/
13. monasky, M., Micaglio, E., Locati, E. T., & Pappone, C. (21 de april de 2021). Evaluating the Use of Genetic in Brugada Syndrome Risk Stratification. (T. Ngarmukos, Ed.) Frontiers in Cardiovascular Medicine, 8, 1-8. doi:doi: 10.3389/fcvm.2021.652027.
IDENTIFICACIÓN ORCID
Carolina Vega C: 0000-0002-2591-6416
Juan De Dios González: 0009-0004-5992-8169
Armando Garrido: 0009-0006-5670-8595
Brian Abadia: 0009-0006-6407-2531