

Doctora en Medicina, República de Panamá.1
Recibido 6 de junio 2024; aceptado 17 de julio 2024
Disponible en internet 31 de julio 2024
Palabras Clave: Lesiones traumáticas del encéfalo, diagnóstico por imagen, complicaciones
Key Words: Brain Trauma, diagnostic imaging, complications.
Resumen
El Trauma Craneoencefálico (TCE) se define como interrupciones en las funciones cerebrales cau-sadas por una fuerza física externa, siendo una de las principales causas de discapacidad y morta-lidad a nivel mundial. El objetivo de esta revisión es proporcionar una actualización sobre los me-canismos fisiopatológicos subyacentes y las escalas utilizadas para evaluar y guiar las decisiones terapéuticas en casos de TCE. Históricamente, la escala de coma de Glasgow ha sido empleada para evaluar el estado de alerta y compromiso neurológico, aunque existen otros sistemas de clasi-ficación que utilizan características tomográficas y clínicas para evaluar el daño cerebral y apoyar en la toma de decisiones terapéuticas. A pesar de los avances en prevención y tratamiento, el TCE sigue siendo un grave problema de salud pública. El empleo de dispositivos de monitoreo permite detectar rápidamente alteraciones fisiológicas en pacientes y brindarles el tratamiento oportuno. La terapia combinada es esencial en el tratamiento del TCE, teniendo como objetivo la reducción de la PIC, en algunos casos individualizados, puede requerir una descompresión craneal, ayudan-do a disminuir la mortalidad y mejorar el estado neurológico de los pacientes.
Abstract
Head injuries (TBI) are defined as interruptions in brain functions caused by an external physical force, being one of the leading causes of disability and mortality worldwide. The aim of this re-view is to provide an update on the underlying pathophysiological mechanisms and scales used to evaluate and guide therapeutic decisions in cases of TBI. Historically, the Glasgow Coma Scale has been used to assess the level of alertness and neurological impairment, although there are oth-er classification systems that use tomographic and clinical characteristics to evaluate brain damage and support therapeutic decision-making. Despite advances in prevention and treatment, TBI re-mains a serious public health problem. The use of monitoring devices allows for the rapid detec-tion of physiological disturbances in patients and provides timely treatment. Combined therapy is essential in TBI treatment, aiming at reducing ICP, and in some individualized cases, may require cranial decompression, helping to decrease mortality and improve the neurological status of pa-tients.
Introducción
Los Traumas Craneoencefálicos se definen como interrupciones en las funciones cerebrales o cualquier evidencia de patología cerebral causada por una fuerza física externa. Esta condición representa una de las principales causas de morbilidad, mortalidad y discapacidad en todas las edades, subrayando la necesidad urgente de estrategias efectivas de tratamiento. [1,2,3,4]
La relevancia de esta revisión radica en la alta prevalencia y severidad de los TCE, así como en la necesidad de mejorar continuamente las estrategias terapéuticas para reducir la carga de esta con-dición. El objetivo de esta revisión es proporcionar una actualización sobre los mecanismos fisio-patológicos subyacentes y las escalas utilizadas para evaluar y guiar las decisiones terapéuticas en casos de TCE. Nos enfocaremos en tres áreas clave de avance en el manejo de estas lesiones: (1) terapias protocolizadas en cuidados neurointensivos, (2) la base de evidencia para la craniectomía descompresiva, y (3) nuevas terapias farmacológicas. Con ello, se pretende ofrecer una visión in-tegral de los avances recientes y potenciales en el tratamiento del TCE, con el fin de optimizar los resultados de recuperación y la calidad de vida de los afectados. [1,2,3,4,5]
Epidemiología y factores de riesgo
La incidencia global anual del TCE independientemente de la causa y gravedad, se estima en 939 casos por cada 100 000 personas, afectando a aproximadamente 69 millones de personas cada año. Según la Organización Mundial de la Salud, entre 30%-40% de las muertes relacionadas con lesiones son causadas por TCE. Este es un importante problema sanitario y socioeconómico signi-ficativo tanto en países desarrollados como en aquellos con ingresos bajos y medios. En Panamá, las causas más comunes de TCE son los accidentes viales y las caídas de los pies. Los TCE repre-sentan una causa predominante de mortalidad y discapacidad física permanente en personas me-nores de 40 años a nivel mundial. El costo anual del TCE asciende a aproximadamente 400 mil millones dólares. [1,2,3,4,5,6,7,8]
La prevención del TCE es una estrategia efectiva para reducir su incidencia, en la cual se incluyen medidas para reducir factores de riesgo, tales como: el uso de cascos y cinturones de seguridad en vehículos, la implementación de medidas de seguridad en el lugar de trabajo y la promoción de estilos de vida saludables que reduzcan el riesgo de lesiones. [1,2,3,4]
Definición y clasificación de las lesiones cerebrales traumáticas
Los TCE se pueden clasificar en tres categorías basadas en los mecanismos de lesión: 1. Cerrado: generalmente causado por un impacto contundente que desplaza el cerebro debido a las vibraciones y choques generados durante la contusión. 2. Penetrante: provocado por un cuerpo extraño que penetra el cráneo y atraviesa la duramadre. 3. Explosivo: el cerebro se ve comprometido por la rápida presión de las ondas de choque que transmiten una enorme cantidad de energía desde el parénquima cerebral cerrado del cráneo.
Las características clínicas (dependiendo de su severidad) del TCE incluyen: cefalea, náuseas, afasia, convulsiones, amnesia, anomalías conductuales e incluso coma; algunas de estas manifesta-ciones pueden durar años.[5,9]
Fisiopatología de las lesiones cerebrales traumáticas
El daño del tejido neural asociado con TCE se divide en dos categorías:
· Lesion Cerebral Primaria: incluye hemorragia intracraneal y lesión axonal causada por el impacto inicial, que puede desencadenar una cascada bioquímica asociada a la respuesta inflamatoria del cuerpo que deteriora la función neurológica. [5,9]
· Lesiones Cerebrales Secundarias: resultan de la progresión de eventos bioquímicos y celu-lares posterior a la lesión primaria, provocando disfunción mitocondrial, oxidación, neu-roinflamación, degeneración axonal y apoptosis.[5,9]
La doctrina Monro-Kellie postula una relación directa entre el desarrollo de edema cerebral y las mediciones de la presión intracraneal (PIC). Esta teoría sostiene que el contenido dentro de la bóveda craneal es constante, compuesta por 3 volúmenes: 150ml Sangre, 150ml Líquido Cefalo-rraquídeo (LCR), y 1400ml tejido encefálico; Y que un incremento en el volumen de uno de estos componentes, como un hematoma o una contusión, sin una reducción compensatoria en los otros, resultará en una elevación de la PIC. En el contexto de un TCE, una PIC elevada (>/= 22 mm Hg) puede surgir tanto del aumento del volumen de sangre intracraneal o una obstrucción en el flujo y/o absorción del LCR, así como de las lesiones secundarias, incluyendo el desarrollo de edema cerebral. [10,11,12]
Investigaciones clínicas han mostrado que las lesiones secundarias pueden ser prevenidas median-te la rápida identificación y el tratamiento adecuado y oportuno de las lesiones primarias. Las guías actuales de práctica clínica para el manejo de TCE tienen como objetivo principal mejorar los resultados neurológicos minimizando las lesiones secundarias durante la fase aguda de la le-sión. [5]
Respuesta inflamatoria y cascada de eventos
Vías implicadas en el edema citotóxico
El edema citotóxico (CytE, por sus siglas en inglés) se produce debido a la incapacidad de activar adecuadamente los canales iónicos, resultando en una pérdida del equilibrio iónico homeostático. Esta disfunción provoca una inflamación celular y la transferencia de agua desde el espacio inters-ticial al interior de las células, lo que lleva a la acumulación de líquido intracelular conocido como edema. Este proceso puede iniciarse tan pronto como una hora después de una TCE y puede afec-tar a todas las células del sistema nervioso central (SNC), incluidos los astrocitos, células endote-liales y neuronas. Aunque la inflamación celular no aumenta el volumen total de agua cerebral, sí redistribuye el agua del espacio intersticial al intracelular. [11,12]
Barrera Hematoencefálica y el edema vasogénico
La ruptura de la Barrera Hematoencefálica (BHE) es una factor clave en el desarrollo del edema vasogénico (VasE, por sus siglas en inglés) tras un TCE. La alteración mecánica de la BHE debi-do a la lesión primaria permite la extravasación de agua y proteínas plasmáticas al intersticio del SNC. Esta ruptura inicial puede ser exacerbada por cascadas de segundos mensajeros, incluyendo citoquinas proinflamatorias, factores angiogénicos y la degradación de las uniones estrechas y factores de adhesión, que promueven la extravasación de proteínas y reorganización del citoes-queleto. La permeabilidad máxima de la BHE suele observarse en las primeras horas post-lesión y puede persistir durante 3 a 4 días, con un posible segundo pico de ruptura debido a la activación microglial luego del 5to día post trauma. Este proceso puede incrementar la presión oncótica y obstruir vasos pequeños, causando hipoperfusión e isquemia local, lo cual agrava aún más la dis-función iónica. [11,12,13,14]
Evaluación clínica y diagnóstico
La gravedad clínica de los TCE se estratifica según las puntuaciones de la Escala de coma de Glasgow (GCS, por sus siglas en inglés) clasificándose en: leve (GCS 15-14), moderada (13-9) y grave (=/<8). [2,10] Sistemas adicionales, como la Clasificación de Marshall (tabla 1) y el puntaje de TAC de Rotterdam (tabla 2), se han desarrollado para determinar el pronóstico basado en los ha-llazgos de tomografía axial computarizada (TAC). [10,15,16]

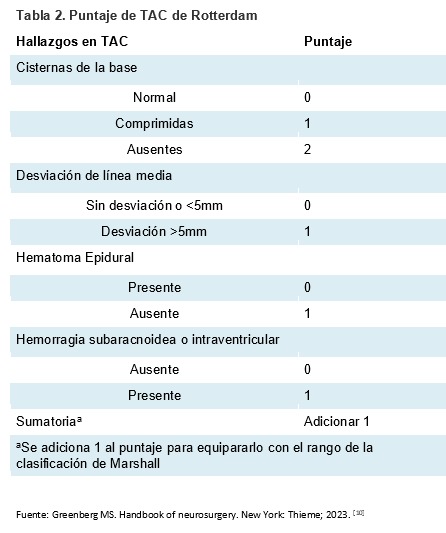
La clasificación de Marshall se creó principalmente para evaluar la severidad del trauma a partir del TAC de ingreso y definir manejo, su riesgo de deterioro neurológico y mortalidad; la puntua-ción de Rotterdam, obtenida a partir de una TAC de cráneo sin contraste realizada en las primeras 4 horas después de la lesión, proporciona una predicción más precisa. Esta puntuación se correla-ciona con un porcentaje específico de mortalidad a los 6 meses. [10,15]
Medidas Diagnósticas y de Monitorización en TCE
Los protocolos para la neuroprotección en pacientes con lesiones cerebrales traumáticas incluyen varias intervenciones clave: la corrección de la hipoxia e hipotensión mediante reanimación, el uso de hipotermia terapéutica, la monitorización de la PIC y la presión de perfusión cerebral (PPC), la profilaxis de las convulsiones y control de la fiebre. [5,10,17]
Monitorización de la Presión Intracraneal.
La medición de la PIC es fundamental en el manejo de los TCE. La Brain Trauma Foundation (BTF, por sus siglas en inglés) ha establecido pautas basadas en la evidencia, recomendando man-tener la PIC entre 20 a 25 mmHg. Un aumento en la PIC reduce la PPC, calculada como la dife-rencia entre la presión arterial media (PAM) y la PIC (PPC = PAM - PIC). [10,13] Una PPC dismi-nuida aumenta el riesgo de isquemia cerebral, en casos severos y sostenidos puede conducir a la herniación cerebral. Se recomienda la monitorización de la PIC en pacientes con TCE grave y TAC anormal; es decir, que revele hematomas, contusiones, edema, herniación o compresión de cisternas de la base. Así como en aquellos con TAC normal que presentan más de dos de los si-guientes criterios: edad superior a 40 años, postura anormal unilateral ó bilateral y presión arterial sistólica inferior a 90 mmHg. [2,3,10,17]
Neuromonitoreo multimodal
Consiste en la integración de la información proveniente de múltiples dispositivos de monitoreo (Moberg®) para permitir la detección temprana de alteraciones fisiológicas. El software de adquisición de datos en tiempo real como ICM+, CNS Monitor y Bedmaster Ex permite tanto la visualización como el análisis de múltiples parámetros junto al paciente.[2,18,19] Además de los mo-nitores de presión intracraneal, se utilizan comúnmente monitores de microdiálisis cerebral (CMD) y oxigenación del tejido cerebral. [2]
Monitorización de la Oxigenación Cerebral
La monitorización (LICOX®/NEUROVENT-PTO®) de la tensión de oxígeno en el tejido cere-bral (PbtO2) se implementa para prevenir la isquemia cerebral durante la hiperventilación terapéu-tica. Esta técnica utiliza una sonda invasiva equipada con un electrodo de Clark modificado, esta-bleciendo un umbral patológico típico de 20 mmHg. [2,10,17]
Microdiálisis cerebral
La microdiálisis cerebral (CMD, por sus siglas en inglés) es un monitor invasivo (ISCUS flex®) que permite la toma de muestras de metabolitos cerebrales en el líquido extracelular a través de un catéter intraparenquimatoso. Esta técnica mide directamente varios analitos, como glucosa, lactato y piruvato, permitiendo el cálculo del índice lactato-piruvato (LPR, por sus siglas en inglés). Un consenso internacional ha definido umbrales específicos: un LPR superior a 25 y una glucemia cerebral inferior a 0.8 mmol/L están asociados con resultados adversos que requieren intervención. [2,10]
Profilaxis de convulsiones
La electroencefalografía continua (EEG, por sus siglas en inglés) se utiliza para monitorizar pa-cientes con convulsiones postraumáticas (PTS, por sus siglas en inglés). Las directrices de BTF recomiendan la profilaxis de PTS con fenitoína o levetiracetam dentro de los primeros 7 días pos-teriores a la lesión, con el fin de limitar las disfunciones neurofisiológicas agudas y prevenir la epilepsia crónica. [2,10,17]
Presión de Perfusión cerebral y Autorregulación Cerebral
Las directrices recientes de BTF sugieren un objetivo de PPC entre 60 y 70 mmHg en pacientes con TCE grave que requieren monitorización de la PIC. La autorregulación cerebral normal impli-ca una vasoconstricción en respuesta al aumento de la PAM para mantener el flujo sanguíneo cerebral y reducir la PIC, mientras que en los TCE la PAM aumenta como respuesta al aumento de la PIC para asi lograr una perfusión cerebral adecuada. [2,10,17]
Uso de Biomarcadores
Aunque no es una práctica sistemática, los biomarcadores se han identificado como útiles para estratificar las necesidades de seguimiento y pronóstico en TCE. Entre los biomarcadores notables se encuentran los gliales (GFAP, S100B), neuronales/axonales (neuron-specific enolase. NSE, por sus siglas en inglés), polipéptido liviano de neurofilamento (NFL, por sus siglas en inglés), ubiqui-tina carboxiterminal hidrolasa L1 (UCH-L1, por sus siglas en inglés), tau, amiloide β, αII-espectrina entre otros. [2,13]
Tratamiento
Craniectomía Descompresiva (DC, por sus siglas en inglés): Existe evidencia que respalda a la DC como una terapia significativa para controlar la presión intracraneal. Aunque ha habido controver-sia en torno a esta técnica quirúrgica debido a debates sobre los aspectos técnicos involucrados, el momento más apropiado para realizar la operación y la selección adecuada de los pacientes, es una medida extrema que busca aliviar la presión en el cerebro en situaciones críticas. [2,3,17,20-25]
Existen dos tipos de craniectomía descompresiva: La primaria, en la que no se reemplaza el colga-jo óseo después de la evacuación de una lesión intracraneal, y la secundaria, donde la remoción del colgajo óseo se realiza posteriormente en el curso del tratamiento del paciente, generalmente cuando la PIC elevada es refractaria a otros tratamientos. [2,17,20]
Dos estudios aleatorios controlados, RESCUEicp (Trial of Decompressive Craniectomy for Traumatic Intracranial Hypertension) y DECRA (Decompressive Craniectomy in patients with Severe Traumatic Brain Injury), han sido fundamentales para evaluar la eficacia de esta técnica. La principal diferencia entre ambos estudios radica en el momento en que se aborda la elevación refractaria de la PIC: temprano en DECRA y tardío en RESCUEicp. [2,17,20] Estos estudios han contribuido significativamente a las recomendaciones actuales, que sugieren que la craniectomía descompresiva mejora la mortalidad y los resultados en pacientes con PIC elevada. Además, se ha demostrado que una craniectomía frontotemporoparietal amplia (12 por 15 cm o con un diámetro de 15 cm) mejora los resultados neurológicos en comparación con una craniectomía más peque-ña.[2,20-25]
Terapia de Hipotermia
La hipotermia terapéutica se clasifica tradicionalmente en tres categorías: media (34 ºC - 35 ºC), moderada (32 ºC - 33.9 ºC), y severa (<32 ºC). [2,5,14] La duración de la hipotermia también es im-portante, dividiéndose en a corto plazo (<48hrs) y a largo plazo (más de 48hrs), [2,5,17] y puede ser inducida de manera temprana (< 24 horas desde la lesión) o tardía (> 24 horas después de la le-sión). [2,26, 27] Estudios clínicos no logran demostrar beneficios y, además, sugiere posibles daños relacionados con esta terapia para TCE. [22,26,27]
Dos ensayos aleatorios de fase 3, Eurotherm3235 (2015) y Prophylactic Hypothermia Trial (PO-LAR-RCT, 2018), han evaluado la hipotermia terapéutica. Eurotherm3235 mostró que la hipoter-mia moderada combinada con tratamiento estándar para reducir la PIC estaba asociada con una mayor mortalidad y peores resultados funcionales en comparación con el tratamiento estándar solo. Una revisión Cochrane de 2016 no encontró evidencia de que la hipotermia leve redujera la mortalidad en pacientes con TCE grave. [2,17,26, 27]
POLAR-RCT no demostró beneficios significativos de la hipotermia profiláctica temprana sobre los resultados neurológicos y la mortalidad a los 6 meses. [2,17,26,27, 28]
Drenaje Ventricular Externo
El uso de sistemas de drenaje ventricular externo (DVE) en pacientes con una TCE grave es una práctica controvertida. El DVE es un catéter intraventricular conectado a un sistema de drenaje que elimina el exceso de LCR para reducir la PIC [10]. A pesar de su uso, no hay evidencia con-cluyente de que el DVE mejore la supervivencia o reduzca la morbilidad en adultos con TCE gra-ve. Se pueden utilizar sistemas de drenaje continuo para reducir la carga de PIC de manera más efectiva que el drenaje intermitente. También se ha sugerido el uso del drenaje de LCR en pacien-tes con una escala de Glasgow inferior a 6 en las primeras 12 horas después de la lesión. [10,17]<(/p>
Tratamiento farmacológico para TCE
Actualmente, no existe una farmacoterapia comprobada para el tratamiento de TCE de moderado a severo. El manejo clínico del CE se centra en reducir la PIC y mantener la PPC. Se desaconseja el uso de esteroides para mejorar el pronóstico o reducir la PIC; se han explorado otras terapias para esta condición, como el ácido tranexámico, eritropoyetina (EPO, por sus siglas en inglés) y antagonista del receptor de interleucina-1 recombinante (rIL 1ra, por sus siglas en inglés), aunque la evidencia actual sobre su eficacia es limitada.[2]
Aunque algunos tratamientos farmacológicos moleculares se están investigando para limitar el uso de terapias no dirigidas [11,13], se requiere de una mayor investigación para que estos enfoques sean aceptados en la práctica clínica.
Conclusiones
A pesar de los avances en prevención y tratamiento, el TCE sigue siendo un grave problema de salud pública. El empleo de dispositivos de monitoreo permite detectar rápidamente alteraciones fisiológicas en pacientes y brindarles el tratamiento oportuno. La terapia combinada es esencial en el tratamiento del TCE teniendo como objetivo la reducción de la PIC, en algunos casos indivi-dualizados, puede requerir una DC, ayudando a disminuir la mortalidad y mejorar el estado neu-rológico de los pacientes.
REFERENCIA BIBLIOGRÁFICA
1. Gonzalez Mojica JD, Lezcano H, Hinestroza A, Ortega N. Características Clínicas y Terapéuti-cas de los Pacientes que Ingresan por Trauma Craneoencefálico en el Complejo Hospitalario Dr. Arnulfo Arias Madrid. 2022 - 2023. Rev Med Panama [Internet]. 2024;63–8. Disponible en: http://dx.doi.org/10.37980/im.journal.rmdp.20242298
2. Khellaf A, Khan DZ, Helmy A. Recent advances in traumatic brain injury. J Neurol [Internet]. 2019;266(11):2878–89. Disponible en: http://dx.doi.org/10.1007/s00415-019-09541-4.
3. Iaccarino C, Lippa L, Munari M, Castioni CA, Robba C, Caricato A, et al. Management of in-tracranial hypertension following traumatic brain injury: a best clinical practice adoption proposal for intracranial pressure monitoring and decompressive craniectomy. Joint statements by the Traumatic Brain Injury Section of the Italian Society of Neurosurgery (SINch) and the Neuroan-esthesia and Neurocritical Care Study Group of the Italian Society of Anesthesia, Analgesia, Re-suscitation and Intensive Care (SIAARTI). J Neurosurg Sci [Internet]. 2021;65(3). Disponible en: http://dx.doi.org/10.23736/s0390-5616.21.05383-2
4. Rakhit S, Nordness MF, Lombardo SR, Cook M, Smith L, Patel MB. Management and chal-lenges of severe traumatic brain injury. Semin Respir Crit Care Med [Internet]. 2021;42(01):127–44. Disponible en: http://dx.doi.org/10.1055/s-0040-1716493
5. Wu X, Tao Y, Marsons L, Dee P, Yu D, Guan Y, et al. The effectiveness of early prophylactic hypothermia in adult patients with traumatic brain injury: A systematic review and meta-analysis. Aust Crit Care [Internet]. 2021;34(1):83–91. Disponible en: http://dx.doi.org/10.1016/j.aucc.2020.05.005
6. Jost JN. Primary decompressive craniectomy after traumatic brain injury: A literature review. Cureus [Internet]. 2022; Disponible en: http://dx.doi.org/10.7759/cureus.29894
7. Injuries [Internet]. Mortality DB. [citado el 24 de mayo de 2023]. Disponible en: https://platform.who.int/mortality/themes/theme-details/mdb/injuries
8. Dewan MC, Rattani A, Gupta S, Baticulon RE, Hung Y-C, Punchak M, et al. Estimating the global incidence of traumatic brain injury. J Neurosurg [Internet]. 2019;130(4):1080–97. Disponi-ble en: http://dx.doi.org/10.3171/2017.10.jns17352
9. Ng SY, Lee AYW. Traumatic brain injuries: Pathophysiology and potential therapeutic targets. Front Cell Neurosci [Internet]. 2019;13. Disponible en: http://dx.doi.org/10.3389/fncel.2019.00528
10. Greenberg MS. Handbook of neurosurgery. 10a ed. Nueva York, NY, Estados Unidos de América: Thieme Medical; 2023.
11. Jha RM, Kochanek PM, Simard JM. Pathophysiology and treatment of cerebral edema in traumatic brain injury. Neuropharmacology [Internet]. 2019;145:230–46. Disponible en: http://dx.doi.org/10.1016/j.neuropharm.2018.08.004
12. Jha RM, Raikwar SP, Mihaljevic S, Casabella AM, Catapano JS, Rani A, et al. Emerging ther-apeutic targets for cerebral edema. Expert Opin Ther Targets [Internet]. 2021;25(11):917–38. Disponible en: http://dx.doi.org/10.1080/14728222.2021.2010045
13. Jha RM, Kochanek PM. A precision medicine approach to cerebral edema and intracranial hy-pertension after severe traumatic brain injury: Quo Vadis? Curr Neurol Neurosci Rep [Internet]. 2018;18(12). Disponible en: http://dx.doi.org/10.1007/s11910-018-0912-9
14. Halstead MR, Geocadin RG. The medical management of cerebral edema: Past, present, and future therapies. Neurotherapeutics [Internet]. 2019;16(4):1133–48. Disponible en: http://dx.doi.org/10.1007/s13311-019-00779-4
15. Elkbuli A, Shaikh S, McKenney K, Shanahan H, McKenney M, McKenney K. Utility of the Marshall & Rotterdam classification scores in predicting outcomes in trauma patients. J Surg Res [Internet]. 2021;264:194–8. Disponible en: http://dx.doi.org/10.1016/j.jss.2021.02.025
16. Sahuquillo J, Dennis JA. Decompressive craniectomy for the treatment of high intracranial pres-sure in closed traumatic brain injury. Cochrane Libr [Internet]. 2019;2019(12). Disponible en: http://dx.doi.org/10.1002/14651858.cd003983.pub3
17 Edition 4th. Guidelines for the management of severe traumatic brain injury [Internet]. Squa-respace.com. [citado el 20 de julio de 2023]. Disponible en: https://static1.squarespace.com/static/63e696a90a26c23e4c021cee/t/640b5e97fa1baa040e5c59a f/1678466712870/Management_of_Severe_TBI_4th_Edition.pdf#page134
18. Natus Medical Incorporated [Internet]. Natus. Natus Medical Incorporated; 2023 [citado el 20 de julio de 2023]. Disponible en: https://www.moberg.com/
19. ICM+ software for brain monitoring in neurological intensive care research [Internet]. Cam-bridge Enterprise. 2011 [citado el 20 de julio de 2023]. Disponible en: https://www.enterprise.cam.ac.uk/reagents/icm-software-for-brain-monitoring-in-neurologic al-intensive-care-research
20. Hawryluk GWJ, Rubiano AM, Ghajar J. In reply: Guidelines for the management of severe traumatic brain injury: 2020 update of the decompressive craniectomy recommendations. Neuro-surgery [Internet]. 2021;88(4):E372–3. Disponible en: http://dx.doi.org/10.1093/neuros/nyaa576
21. Hashmi SMM, Nazir S, Colombo F, Jamil A, Ahmed S. Decompressive craniectomy for the treatment of severe diffuse traumatic brain injury: A randomized controlled trial. Asian J Neuro-surg [Internet]. 2022;17(03):455–62. Disponible en: http://dx.doi.org/10.1055/s-0042-1756636
22. Escamilla-Ocañas CE, Albores-Ibarra N. Estado actual y perspectivas futuras en el manejo de la hipertensión intracraneal posterior a traumatismo craneoencefálico: craniectomía descompresiva, hipotermia terapéutica y barbitúricos. Neurologia [Internet]. 2023;38(5):357–63. Disponible en: http://dx.doi.org/10.1016/j.nrl.2020.08.007
23. Zhang Q, Li Y, Chang X. Role of decompressive craniectomy in the management of traumatic brain injury - A meta-analysis of randomized controlled trials. Ann Indian Acad Neurol [Inter-net]. 2023;26(6):966–74. Disponible en: http://dx.doi.org/10.4103/aian.aian_432_23
24. Geyik AM. Role of early decompressive craniectomy in traumatic brain injury; Our clinical experience. Ulus Travma Acil Cerrahi Derg [Internet]. 2021; Disponible en: http://dx.doi.org/10.14744/tjtes.2021.23176
25. Silva ACV, de Oliveira Farias MA, Bem LS Jr, Valença MM, de Azevedo Filho HRC. De-compressive craniectomy in traumatic brain injury: An institutional experience of 131 cases in two years. Neurotrauma Rep [Internet]. 2020;1(1):93–9. Disponible en: http://dx.doi.org/10.1089/neur.2020.0007
26. Watson HI, Shepherd AA, Rhodes JKJ, Andrews PJD. Revisited: A systematic review of therapeutic hypothermia for adult patients following traumatic brain injury. Crit Care Med [Inter-net]. 2018;46(6):972–9. Disponible en: http://dx.doi.org/10.1097/ccm.0000000000003125
27. Flynn LMC, Rhodes J, Andrews PJD. Therapeutic hypothermia reduces intracranial pressure and partial brain oxygen tension in patients with severe traumatic brain injury: Preliminary data from the Eurotherm3235 trial. Ther Hypothermia Temp Manag [Internet]. 2015;5(3):143–51. Dis-ponible en: http://dx.doi.org/10.1089/ther.2015.0002.
28. Cooper DJ, Nichol AD, Bailey M, Bernard S, Cameron PA, Pili-Floury S, et al. Effect of early sustained prophylactic hypothermia on neurologic outcomes among patients with severe traumatic brain injury: The POLAR randomized clinical trial. JAMA [Internet]. 2018;320(21):2211. Dis-ponible en: http://dx.doi.org/10.1001/jama.2018.17075.
IDENTIFICACIÓN ORCID
Stephany Morales: J0009-0007-6836-3552